
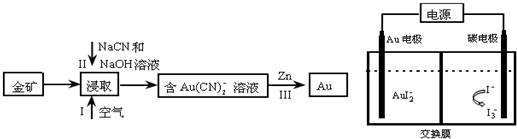
分析 (1)NaCN中钠显+1价,氮显-3价,根据化合价代数和为0确定C元素的化合价,钠、C、氨气加热条件下制备氰化钠,根据元素守恒书写化学方程式;
(2)金矿在通入空气的条件下用氰化钠和氢氧化钠溶液浸取,空气中的氧气氧化金,生成含[Ag(CN)2]-的溶液,也可以用双氧水代替氧气,双氧水为液态,与矿石混合更均匀,接触面积大,氧化充分,将含[Ag(CN)2]-的溶液中用锌还原出金,若改用I2-NaI溶液进行浸取,将会得到含[AuI2]-溶液,采用电解法提炼金,则阴极上发生还原反应产生金,阳极上发生氧化反应生成碘单质,据此答题;
(3)2×10-5mol/LAgNO3标准溶液12.50mL含有AgNO3的物质的量为2.5×10-7mol,根据反应Ag++2CN-=[Ag(CN)2]-;,可知10.00mL饮用水样品中含有的CN-的物质的量为1×10-6mol,据此计算浓度并确定是否超标.
解答 解:(1)NaCN中钠显+1价,氮显-3价,根据化合价代数和为0可生C元素的化合价为+2价,钠、C、氨气加热条件下制备氰化钠,反应的化学方程式为2Na+2C+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2NaCN+3H2↑,
故答案为:+2;2Na+2C+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2NaCN+3H2↑;
(2)金矿在通入空气的条件下用氰化钠和氢氧化钠溶液浸取,空气中的氧气氧化金,生成含[Ag(CN)2]-的溶液,也可以用双氧水代替氧气,双氧水为液态,与矿石混合更均匀,接触面积大,氧化充分,将含[Ag(CN)2]-的溶液中用锌还原出金,若改用I2-NaI溶液进行浸取,将会得到含[AuI2]-溶液,采用电解法提炼金,则阴极上发生还原反应产生金,阳极上发生氧化反应生成碘单质,
①根据上面的分析可知,用5%H2O2溶液代替空气可提高浸取率,是因为H2O2溶液为液态,与矿石混合更均匀,接触面积大,氧化充分,采用电解法提炼金中,阳极电极反应式为3 I--2e-=I3-,消耗 I-,阴极上生成金的同时产生I-,所以交换膜为阴离子交换膜,
故答案为:H2O2溶液为液态,与矿石混合更均匀,接触面积大,氧化充分;3 I--2e-=I3-;阴;
②反应Ⅲ属于置换反应,反应的离子反应式为Zn+2[Au(CN)2]-═[Zn(CN)4]2-+2Au,
故答案为:Zn+2[Au(CN)2]-═[Zn(CN)4]2-+2Au;
(3)2×10-5mol/LAgNO3标准溶液12.50mL含有AgNO3的物质的量为2.5×10-7mol,根据反应Ag++2CN-=[Ag(CN)2]-;,可知10.00mL饮用水样品中含有的CN-的物质的量为1×10-6mol,所以饮用水样品中含有的CN-的浓度为1×10-4mol/L=1.3mg/L>0.07mg/L,所以该饮用水中氰含量是超标的,
故答案为:1.3;是.
点评 本题考查物质的分离与提纯方法的综合应用及制备实验方案的设计,题目难度中等,涉及化学计算、化合价和离子反应方程式的书写等知识,明确实验目的、实验原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:推断题
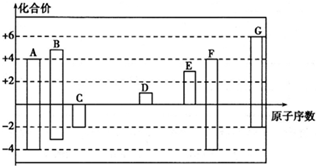
 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | Ka1=1.54×10-2 |
| Ka2=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 在1mol•L-1NaHA(酸式盐)溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 已知某温度下常见弱酸的电离平衡常数如上表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 | |
| D. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
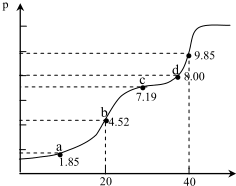
| A. | a 点所得溶液中;2n(H2A)+n(A2-)=0.002mol | |
| B. | b 点所得溶液中:c(H2A)+c(H+)=c(A2-)+c(OH-) | |
| C. | c 点所得溶液中:c(Na+)<3c(HA-) | |
| D. | d 点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 | B. | 0.10 | C. | 0.04 | D. | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
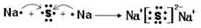 .其所含化学键类型为离子键.
.其所含化学键类型为离子键. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com