
分析 令A的物质的量为2mol,由方程式可知混合气体总物质的量为6mol,根据混合气体相对氢气密度计算混合气体的平均摩尔质量,根据m=nM计算混合气体总质量,由质量守恒定律可知A的质量等于混合气体总质量,再根据M=$\frac{m}{n}$计算A的摩尔质量.
解答 解:令A的物质的量为2mol,由方程式2A=2B+C+3D,可知混合气体总物质的量为2mol+1mol+3mol=6mol,
混合气体对氢气的相对密度为23,则混合气体平均摩尔质量=2g/mol×23=46g/mol,混合气体总质量=6mol×46g/mol,
由质量守恒定律可知A的质量等于混合气体总质量,故A的摩尔质量=$\frac{6mol×46g/mol}{2mol}$=138g/mol,
故答案为:138.
点评 本题考查物质的量计算、化学方程式计算,难度不大,关键是理解相同条件下气体的摩尔质量和气体的密度成正比


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
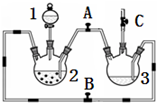 某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离为吸热过程,所以碳酸盐与盐酸反应放热 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则含 40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量多于57.3 kJ | |
| C. | 通过NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,可知 1molH2O(l)完全电离需要吸热57.3kJ | |
| D. | 铝热反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③⑥⑦⑧ | C. | ⑤⑥⑦⑧ | D. | ④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变,降温,平衡右移,逆反应速率增大 | |
| B. | 保持体积、温度不变,充入氦气后,正反应速率将增大 | |
| C. | 保持体积、温度不变,充入NH3气体,平衡向右移动 | |
| D. | 保持温度、压强不变,充入NH3气体,平衡混合气中NH3的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,气体体积的大小,由构成气体的分子大小决定 | |
| B. | 一定温度和压强下,气体体积的大小,由构成气体的分子数决定 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 气体摩尔体积指1mol任何气体所占的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com