
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
分析 A、吸热反应不一定是非自发的,放热反应有的也需要加热才能进行;
B、增大压强可以通过缩小体积来实现;
C、反应方向的判据是△G=△H-T△S,△G>0反应不能自发进行,△G<0反应能自发进行,△G=0达到平衡;
D、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变.
解答 解:A、反应方向的判据是△G=△H-T△S,故吸热反应不一定是非自发的;放热反应有的也需要加热才能进行,如煤炭的燃烧,故A错误;
B、增大压强可以通过缩小体积来实现,故增大压强后,活化分子百分数不变,只是增大了单位体积内的活化分子数目,从而反应速率加快,故B错误;
C、反应方向的判据是△G=△H-T△S,△G>0反应不能自发进行,△G<0反应能自发进行,△G=0达到平衡,故熵增的反应不一定能自发进行,故C错误;
D、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变,即应用盖斯定律,可计算某些难以直接测量的反应焓变,故D正确.
故选D.
点评 本题虽难度不大,但考查范围广,考查知识基础、全面,是一道好题,符合现在的高考思路.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
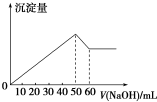 在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )| A. | 1:1 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
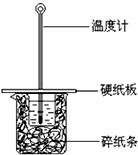 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )| A. | 采用0.55mol/L的NaOH溶液是保证盐酸完全被中和 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是保温隔热,防止热量损失 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
试剂 用量 (mL) | 0.20mol•L-1(NH4)2 S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20mol•L-1KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010mol•L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20mol•L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20mol•L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH的电离程度增大,c(H+)增大 | |
| B. | 平衡向生成CH3COOH移动,c(H+)减小 | |
| C. | CH3COOH电离程度减小,pH减小 | |
| D. | 电离平衡向生成CH3COO-、H+方向移动,pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉漂白物质时发生的发应和变质失效时的反应一样 | |
| B. | 将氯气溶于水中,当水中各成分浓度保持不变时,即表示反应停止 | |
| C. | 二氧化硅固体是由原子直接构成的,那么固态二氧化碳也是由原子直接构成 | |
| D. | 碱金属(如钾、钠等)可以存放在所有有机溶剂中,而白磷则应保存在水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com