
【题目】研究金属与硝酸的反应,实验如下。
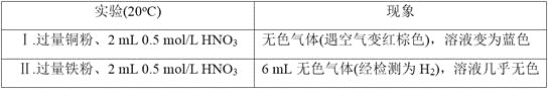
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________________________________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是_______________________________。
②乙同学通过分析,推测出NO3-也能被还原,依据是___________________________,进而他通过实验证实该溶液中含有NH4+,其实验操作是__________________________
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有_________________________试推测还可能有哪些因素影响_________(列举1条)。
【答案】NO或一氧化氮 Fe+2H+===Fe2++H2↑ 硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出 NO3- 中氮元素的化合价为最高价,具有氧化性 取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 金属的种类、硝酸的浓度 温度
【解析】
(1)铜与硝酸反应生成无色气体,该气体与空气变红,故该气体是NO;
(2)Ⅱ中铁与硝酸溶液中的H+发生氧化还原反应生成H2;
(3)①如果硝酸根离子没有发生反应,则Ⅰ溶液不会变蓝,溶液变蓝说明铜被氧化为铜离子;
②元素化合价处于最高价,具有氧化性,NH4+的检验可以与浓的氢氧化钠溶液在加热的条件下反应,产生的气体通过湿润的红色石蕊试纸来检验;
(4)金属与硝酸反应时,影响硝酸还原产物不同的因素是金属活泼性、硝酸的浓度、温度。
(1)铜与硝酸反应生成无色气体,该气体与空气变为红棕色,故该气体为NO,红棕色的气体为NO2;
(2)Ⅱ中铁与硝酸溶液中的H+发生氧化还原反应生成H2,离子反应方程式为:Fe+2H+=Fe2++H2↑;
(3)①如果硝酸根离子没有发生反应,则Ⅰ溶液不会变蓝,溶液变蓝说明铜被氧化为铜离子,其实验证据是硝酸浓度相同,铜的还原性比铁的还原性弱,但Ⅰ中溶液变蓝,同时没有氢气放出;
②元素化合价处于最高价,具有氧化性,NO3-中氮元素的化合价为最高价,具有氧化性,被还原;
NH4+的检验可以与浓的氢氧化钠溶液在加热的条件下反应,产生的气体通过湿润的红色石蕊试纸来检验,具体操作为:取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体;
(4)金属与硝酸反应时,影响硝酸还原产物不同的因素是金属活泼性、硝酸的浓度、温度。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】化学计盘在化学中占有重要地位,请回答下列问题。
(1)相同质量的SO2和SO3所含氧原子的个数比为______。
(2)质量相同的A、B两种气体,在同温同压下,A的分子数比B多,则A的密度_____ B的密度(填>、=、<)。
(3)焦亚硫酸纳(Na2 S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。果脯中的Na2 S2O5的使用量是以游离的SO2来计算的,我国规定每千克果脯中SO2的最高含量是0.35g。
①下列试剂可用于检测SO2的是_________。
A.I2 B.HC1 C. H2SO4 D.CS2
②某500g果脯样品经检测得知含有SO2的物质的量为0.005 mol,该产品是否合格_________ (填“是”或“否”)。
(4)“84消毒液”是常用的含氯消毒剂,可以利用Cl2与NaOH反应制得该产品。反应的离子方程式为_______。“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制1 000 mL 0.50 mol L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为___。
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___kJ。
(3)一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
①在0~20min时段,反应速率v(N2O)为___mol·(L·min)-1。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=___。
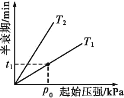
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___(填“>”“=”或“<”)T2。当温度为T1、起始压强为p0时,反应至t1min时,体系压强p=___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g)![]() N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步 IO(g)+N2O(g)![]() N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2的浓度与N2O分解速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是

①分子式为C10H18O3
②易溶于水
③分子中含有两种官能团
④可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
⑤能发生加成、取代、酯化、消去、催化氧化等反应
⑥所有的原子可能共平面
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质。
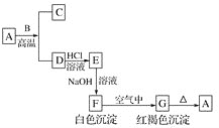
(1)写出下列物质的化学式:A________、E________、F________、G________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:_________________________________;
②F→G的化学方程式:________________________________________________;
③E→F的离子方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】司替戊醇(d)用于治疗两岁及以上Dravet综合征相关癫痫发作患者,其合成路线如图所示。下列有关判断正确的是( )

A.b的一氯代物有4种
B.c的分子式为C14H14O3
C.1mold最多能与4molH2发生加成反应
D.d中所有碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关同分异构体的说法,错误的是
A.若两种有机物互为同分异构体,则二者的分子式相同
B.分子式为C5H12的的同分异构体有3种
C.1-丁烯、2-丁烯均存在顺反异构
D.同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com