
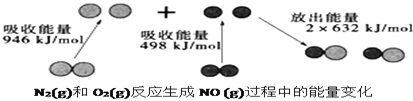
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为![]() 和
和![]() 反应生成
反应生成![]() 过程中的能量变化,下列说法中正确的是
过程中的能量变化,下列说法中正确的是
A.![]() 和
和![]() 完全反应放出的能量为180kJ
完全反应放出的能量为180kJ
B.通常情况下,![]() 和
和![]() 混合能直接生成NO
混合能直接生成NO
C.![]() 和
和![]() 具有的总能量小于
具有的总能量小于![]() 具有的总能量
具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
【答案】C
【解析】
A. 焓变就是断裂反应物化学键吸收的总能量与形成生成物化学键所放出的总能量的差值,根据题意可知:1 mol N2(g)和1 mol O2(g)发生反应的反应热△H=946 kJ/mol+498 kJ/mol-2×632 kJ/mol=+180 kJ/mol,所以该反应是吸热反应,A错误;
B. N2(g)和O2(g)在电火花条件下能直接生成NO,B错误;
C. 根据选项A分析可知:该反应为吸热反应,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,C正确;
D. NO是一种不成盐氧化物,不能与NaOH溶液反应,D错误;
答案选C。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中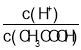 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.将0.1mol/L的NaOH的温度提高至80℃,溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中 值增大的措施是_______________(填序号)。
值增大的措施是_______________(填序号)。
a.加水稀释b.加入少量CH3COONa固体 c.加入少量冰醋酸d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________;该混合溶液中:c(A-)-c(Na+)=______________________mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________(填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL0.2mol/LAgNO3溶液中;
c.100mL0.1mol/L氯化铝溶液中;
d.100mL0.1mol/L盐酸溶液中。
充分搅抖后,相同温度下银离子浓度由大到小的顺序是________________(填写序号);b中氯离子的浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是
A.H2(g)+![]() O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+
O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+![]() O2(g)]生成1 mol [H2O(l)]放热286 kJ
O2(g)]生成1 mol [H2O(l)]放热286 kJ
B.Cr2O72-+ne+14H+=2Cr3++7H2O,则每生成1 mol Cr3+转移电子数为3NA
C.Al3++4OH=[Al(OH)4],说明1 mol Al(OH)3电离出H+数为NA
D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.相对分子质量为72的某烷烃,一氯代物有4种
B.四苯基乙烯![]() 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
D.![]() 和
和![]() 分子组成相差一个“-CH2-”,因此是同系物
分子组成相差一个“-CH2-”,因此是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、Y、Z、Q、R、T 分别代表原子序数依次增大的短周期元素。元素A是原子半径最小的元素;X、Y、Z同周期且相邻,都是蛋白质的组成元素;X、R同族,Q与T原子的最外层电子数之和是R原子最外层电子数的2倍,T单质为淡黄色固体。U是d区元素,U2+的核外最高能级有2对成对电子。请回答下列问题:
(1)Y元素在周期表中的位置______,位于周期表______区;Q原子的核外电子排布式为______。
(2)X、Y、Z元素的第一电离能由大到小的顺序是______。
(3)TZ3分子为______分子(填“极性”或“非极性”),YZ2–离子实际构型是______。
(4)Z和T的简单气态氢化物稳定性好的是______(填化学式),原因是______。
(5)A、X、Z可形成分子式为A2XZ的有机物,则该化合物分子中X原子的轨道杂化类型是______;1mol该分子中含有π键的数目是______。(用“NA”表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx和SO2是环境保护的重要课题。
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq) ΔH= a kJ·mol1
5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq) ΔH= b kJ·mol1
反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq) ΔH=________kJ·mol1。
(2)用电解法处理氮氧化物可回收硝酸。实验室模拟电解NO2的装置如图-1所示。写出电解时阳极的电极反应式:________。
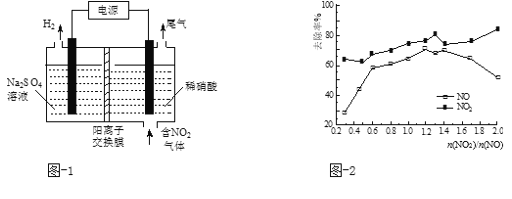
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2。写出该反应的化学方程式:___________。
(4)利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的NO2与活性焦炭反应生成N2和CO2,当生成1 mol N2时,转移的电子数为_________mol。
(5)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变![]() ,NOx的去除率见图-2。
,NOx的去除率见图-2。
①![]() 的合适范围是___________________。
的合适范围是___________________。
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变![]() ,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则![]() 合适的值约为_________。
合适的值约为_________。
a.0.6 b.0.8 c.1.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()
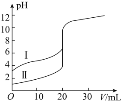
A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL浓H2SO4溶液(足量)中加入3.2 g Cu,在加热条件下充分反应:
(1)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,则原浓硫酸的物质的量浓度为____。
(2)若题干中浓硫酸的物质的量浓度为a mol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)___0.025a mol(填“等于”、“大于”或“小于”)。
(3)反应消耗的H2SO4的物质的量是____,生成SO2的体积为(标准状况下)_____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com