���
�⣺��1��2SO
2��g��+O
2��g��
2SO
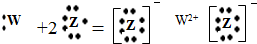
3��g������H��0����Ӧ��ͭ�����С�ķ��ȷ�Ӧ��
A����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�������Ӧ����֮�ȣ���Ӧ����v��SO
2��=v��SO
3��������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬����A����
B�������¶Ⱥ�����������䣬����2mol N
2��������ƽ���ص����壬��ѹ����ѹ���䣬��ѧ��Ӧ���ʲ��䣬��B����
C��ƽ��������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ���һ�ַ�Ӧ���ת����һ�������������ת���ʼ�С����C����
D��ƽ����ƶ�����ѹ�����壬ѹǿ����ƽ��������У�ƽ��ʱSO
2��O
2�İٷֺ�����С��SO
3�İٷֺ�������D��ȷ��
E�������¶Ⱥ�����������䣬ƽ����ٳ���2molSO
3���൱������ѹǿ��ƽ��������У��ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�E��ȷ��
F����Ӧ�Ƿ��ȷ�Ӧ��ƽ��������¶ȣ�ƽ��������У�ƽ�ⳣ��K��С����F����
�ʴ�Ϊ��DE��
��2����ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ��
2SO
2��g��+O
2��g��
2SO
3��g����
��ʼ����mol�� 4 2 0
�仯����mol�� 2.4 1.2 2.4
ƽ������mol�� x 0.8 2.4
v��SO
2����ʾ�ķ�Ӧ����=
=0.2mol/L?min��
ʵ��2���ݻ�ѧƽ������ʽ��ʽ
2SO
2��g��+O
2��g��
2SO
3��g����
��ʼ����mol�� 4 2 0
�仯����mol�� 3.6 1.8 3.6
ƽ������mol�� 0.4 y 3.6
y=0.2mol��
�ʴ�Ϊ��0.2 mol?L
-1?min
-1�� 0.2 mol��
�����ݷ�Ӧ��ʼ����ͬ���ﵽƽ��ʱ�������ʵ�����֪��ʵ��2��Ӧ���еij̶ȴ�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ�ƽ�������ȷ�Ӧ������У�������У������¶�T
1��T
2��ʵ��2�д�ƽ��ʱ O
2��ת����=
��100%=90%���ʴ�Ϊ������90%��
��3��������0.1mol/L Na
2SO
3��Һ��ʵ��ⶨ��pHԼΪ8�������������ˮ����Һ�ʼ��ԣ�
�ٸ���Һ��c��Na
+��=0.2mol/L��c��OH
-��=
=10
-6mol/L������Һ��c��Na
+����c��OH
-��֮��=10
-6mol/L��0.2mol/L=2��10
5 ��1���ʴ�Ϊ��2��10
5��
�ڳ�����0.1mol/L Na
2SO
3��Һ������Һ�д��������غ㣬c��OH
-��=c��H
+��+c��HSO
3-��+2c��H
2SO
3�����ʴ�Ϊ��c��HSO
3-��+2c��H
2SO
3����
�۳�����0.1mol/L Na
2SO
3��Һ�������������ˮ����Һ�ʼ��ԣ�SO
32-+H
2O?HSO
3-+OH
-����������NaOH�����ܽ������������Ũ������ˮ��ƽ��������У�
c��SO
32-�� ����c��Na
+�����ʴ�Ϊ����������
��4������ú������ʵ������ʵ����и���Һ�ֱ�������SO
2���������������ɶൽ�ٵ�˳����
A��Na
2CO
3 ���ն����������ķ�ӦΪ��Na
2CO
3+2SO
2+H
2O=2NaHSO
3+CO
2����1molNa
2CO
3 ������ն�������2mol��
B��Ba��NO
3��
2 ���ն�������Ӧ��ѧ����ʽΪBa��NO
3��
2+3SO
2+2H
2O=BaSO
4��+2H
2SO
4+2NO����1molBa��NO
3��
2������ն�������3mol��
C��Na
2S ���ն����������ķ�ӦΪ��2Na
2S+5SO
2+2H
2O=4NaHSO
3+3S����1mol2Na
2S��෴Ӧ��������2.5mol��
D������KMnO
4��Һ���ն�������ķ�Ӧ2MnO
4-+5SO
2+2H
2O=2Mn
2++5SO
42-+4H
+��1molKMnO
4��෴Ӧ��������2.5mol��
����������ն������������������ɶൽ�ٵ�˳����B��C=D��A��
�ʴ�Ϊ��B��C=D��A��



 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�