
【题目】数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的成分:
空气的成分 | N2、O2、CO2、水蒸气及稀有气体He、Ne等 |
原始大气 的成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白。
(1)含有10个电子的化学式有(填化学式,下同)________。
(2)由极性键构成的非极性分子有________。
(3)与H+可直接形成配位键的分子有________。
(4)分子中不含孤电子对的分子(除稀有气体外)有_______,它的立体构型为______。
(5)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
【答案】(1)H2O、Ne、CH4、NH3
(2)CH4、CO2(3)NH3、H2O
(4)CH4 正四面体形
(5)N2 不相同 配位键
【解析】(1)10e-分子可以用氖(Ne)作为标准,依次找出与氖同周期的元素与氢形成的化合物,有HF、H2O、NH3、CH4,题干要求用表中分子填空,不应填写HF。
(2)由极性键构成的非极性分子应是含有极性键且分子有对称结构的,应是CH4和CO2。
(3)H+有空轨道,与它形成配位键的分子应有孤电子对,据![]() 知,NH3和H2O可以和H+以配位键结合分别形成NH
知,NH3和H2O可以和H+以配位键结合分别形成NH![]() 和H3O+。
和H3O+。
(4)甲烷电子式为 ,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
(5)根据信息O![]() C知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,O
C知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,O![]() C中“→”表示氧原子单方提供电子对,是配位键。
C中“→”表示氧原子单方提供电子对,是配位键。


科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图所示,下列有关叙述中正确的是( ) 
A.有机物A与浓硫酸混合加热,可以发生消去反应
B.1 molA 与足量的H2发生加成反应,最多可以消耗4mol H2
C.1 molA 与足量的NaOH 溶液充分反应,最多可以消耗4 mol NaOH
D.有机物A 的同分异构体中能在稀硫酸存在下水解生成二苯酚的有6 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中有错误的是
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线
C. 用淘洗的方法从沙里淘金
D. 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)常温下,0.1mol/LHCl溶液的pH=;0.005mol/LBa(OH)2溶液的pH=;
(2)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)
①若所得混合溶液呈中性,则a:b=;
②若所得混合溶液pH=12,则a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp).例如:Cu(OH)2 ![]() Cu2++2OH﹣ , Ksp=c(Cu2+)[c(OH﹣)]2=2×10﹣20 . 当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
Cu2++2OH﹣ , Ksp=c(Cu2+)[c(OH﹣)]2=2×10﹣20 . 当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于 .
(2)要使0.2molL﹣1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,加入Ba(OH)2试剂(可加热)既能产生气体又能产生沉淀的一组是 ( )
A.Na2SO4B.Na2CO3C.MgCl2D.(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图分别是A,B两种物质的核磁共振氢谱,已知A,B两种物质都是烃类,都含有6个氢原子,试根据两种物质的核磁共振氢谱推测A,B有可能是下面的( ) 
A.A是C3H6 , B是C6H6
B.A是C2H6 , B是C3H6
C.A是C2H6 , B是C6H6
D.A是C3H6 , B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础.
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式 已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣25kJmol﹣1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣47kJmol﹣1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJmol﹣1③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体. ①写出该反应的离子方程式: .
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4(g) ![]() N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c.N2H4和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图1所示,其中曲线b表示的是(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有(任写一种).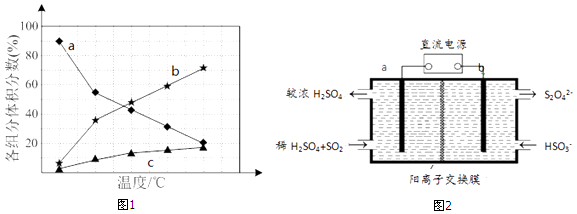
(3)大气污染气的主要成分是SO2和NO2 . 利用图2所示装置(电极均为惰性电极)可以吸收SO2 , 还可以用阴极排出的溶液吸收NO2 . ①a极为(填“阴”“阳”) b极的电极反应式为 .
②简述该装置能吸收SO2的原理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度为2.68g/L(折算成标准状况),该有机物能与金属钠反应.试回答:
(1)通过计算求出该有机物的分子式.
(2)写出该有机物可能的结构简式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com