
【题目】有关物质的量的计算
(1) 1mol HCl中含有HCl分子的个数是_______________________,1.204×1023个CH4分子的物质的量是____________mol。
(2)17克NH3的物质的量是 ______ mol,0.1mol H2O的质量是______________________g。
(3)标准状况下,11.2L O2的物质的量是 ______ mol ,1mol O2的体积是 ______ L。
(4)将8g NaOH配制成1L溶液,其物质的量浓度为_______________mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量是______________g。
【答案】 6.02×1023 0.2 1 1.8 0.5 22.4 0.2 40
【解析】(1)1mol HCl中含有HCl分子的个数1mol×6.02×1023mol-1=6.02×1023,1.204×1023个CH4分子的物质的量为![]() =0.2mol,故答案为:6.02×1023;0.2 mol;
=0.2mol,故答案为:6.02×1023;0.2 mol;
(2)17克NH3的物质的量为![]() =1mol,0.1mol H2O的质量为0.1mol ×18g/mol=1.8g,故答案为:1 mol;1.8;
=1mol,0.1mol H2O的质量为0.1mol ×18g/mol=1.8g,故答案为:1 mol;1.8;
(3)标准状况下,11.2L O2的物质的量为![]() =0.5mol ,1mol O2的体积为1mol×22.4L/mol =22.4L,故答案为:0.5;22.4 ;
=0.5mol ,1mol O2的体积为1mol×22.4L/mol =22.4L,故答案为:0.5;22.4 ;
(4)将8g NaOH配制成1L溶液,其物质的量浓度为![]() =0.2mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量为1L ×1mol/L×40g/mol=40 g,故答案为:0.2 ;40。
=0.2mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量为1L ×1mol/L×40g/mol=40 g,故答案为:0.2 ;40。
点晴:有关物质的量的计算必须紧紧抓住计算公式,n=![]() 、n=
、n=![]() 、n=
、n=![]() 、c=
、c=![]() 。在使用时要注意区分。n=
。在使用时要注意区分。n=![]() 与c=
与c=![]() 中的V的含义。
中的V的含义。


科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 碳酸钠用于治疗胃酸过多 B. 稀硫酸用于除铁锈
C. 晶体硅用于制造光导纤维 D. 硫酸钡用于制作石膏绷带
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和二氧化氮气体在室温下可以化合生成一种新的气态化合物A,为了测定A的组成进行以下实验,取Cl2、NO2混合气总体积5L,测定反应后所得气体体积随Cl2在原混合气体中所占体积分数x的变化而变化的规律.实验测知当Cl2所占体积分数为0.2或0.6时,反应后的总体积均为4L.
(1)通过分析和计算求得化合物A的化学式为_______________________________,发生反应的化学方程式_______________________________________________________.
(2)试讨论当x的取值范围不同时,反应后总体积V随x变化的函数关系_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入氯气,打开B阀时,C处红色布条不褪色;关闭B阀时,C处红色布条褪色;由此作出的判断正确的是( )
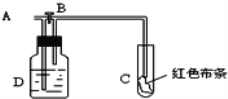
A. D中可能是浓硫酸
B. 通入的氯气含有水蒸气
C. D中可能是水
D. D中可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32—+4H+=SO32—+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
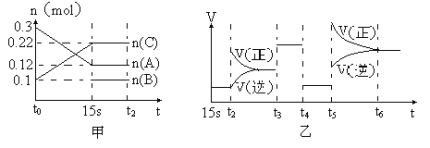
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答下列各小题:
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42- .
(1)常温下,pH=5的NaHSO4溶液中水的电离程度______________(填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:______________(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH![]() )______________c(SO42-)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______________7(填“>”、”=”或“<”)。
)______________c(SO42-)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______________7(填“>”、”=”或“<”)。
(3)将分别含有MnO![]() 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________,一定不存在的是______________。
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________,一定不存在的是______________。
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为________________mol·L1,此时溶液中c(CrO42)等于______________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—有机化学基础】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下:


回答下列问题:
(1)![]() 生成A的反应类型是 。
生成A的反应类型是 。
(2)F中含氧官能团的名称是 ;试剂a的结构简式为 。
(3)写出由A生成B的化学方程式: 。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:。
(5)当试剂d过量时,可以选用的试剂d是 (填字母序号)。
a.NaHCO3 b.NaOH c.Na2CO3
(6)写出C与足量NaOH在一定条件反应的化学方程式 。(不用写条件)
(7)肉桂酸有多种同分异构体,符合下列条件的有 种。
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物最多生成4molAg。
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式 (任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液,可能含有下列离子:Mg2+、A13+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-。取该溶液进行如下实验:①取溶液少许,滴入AgNO3溶液产生白色沉淀;②取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;③取一定量的原溶液,加入一种淡黄色粉末状的固体X,产生气体的物质的量(n气体)、沉淀的物质的量(n沉淀)与加入淡黄色粉末的量(nx)的关系如下图所示(假设生成的气体全部逸出)。

根据实验现象和数据分析正确的是
A. 溶液中肯定大量存在的阳离子只有Mg2+、A13+、NH4+
B. 溶液中肯定没有的离子只有Fe3+、Ba2+
C. 当加入0.6mol淡黄色粉末时,生成两种气体分别为NH3和O2,其对应的体积比为2:3
D. 溶液中可能存在Cl-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com