
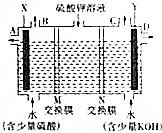
分析 Ⅰ、(1)根据加入的物质知,X电极附近生成硫酸,Y电极附近生成氢氧化钾,则X电极上氢氧根离子放电,Y电极上氢离子放电,所以X是阳极,Y是阴极,阳极与电源正极相连;阳极上生成氧气,阴极上生成氢气;
(2)电解过程中,电解质溶液中阳离子向阴极移动,阴离子向阳极移动;
(3)原电池中负极上失电子发生氧化反应;
Ⅱ、(1)依据盖斯定律结合已知热化学方程式计算得到;
(2)燃料电池中,负极电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极反应式为:O2+2CO2+4e-=2CO32-,电解质溶液中阴离子向负极移动;
(3)依据平衡常数概念结合平衡状态下离子浓度和同时浓度计算得到;
(4)根据NaHCO3溶液的中HCO3-的水解程度大于自身的电离程度来回答.
解答 解:Ⅰ、(1)题图中左边加入含硫酸的水,右侧加入含KOH的水,说明左边制硫酸,右边制备KOH溶液,氢氧根离子在阳极放电,同时电解后溶液呈酸性,氢离子在阴极放电,同时电解后溶液呈碱性,则X为阳极,Y为阴极,所以X连接电源正极;
Y电极上氢离子放电生成氢气,所以氢气从C口导出,
故答案为:正;C;
(2)OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜;
H+在Y极发生还原反应,使右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜,
故答案为:阴离子;阳离子;
(3)氢氧燃料碱性电池中,通入氢气的电极是负极,负极上氢气失电子发生氧化反应,电极反应式为
H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O;
Ⅱ、(1)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ•mol-1
依据盖斯定律①-②得到:C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol,
故答案为:+124.2;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,负极电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极反应式为:O2+2CO2+4e-=2CO32-,所以其电池反应式为C3H8+5O2═3CO2+4H2O,放电时,电解质中阴离子碳酸根离子向负极移动,
故答案为:C3H8+5O2═3CO2+4H2O;负;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H+)=c(HCO3-)=10-5.6mol/L;c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3的第一级电离的平衡常数K1=$\frac{c({H}^{+})•c(HC{O}_{3}-)}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-5.6}×1{0}^{-5.6}}{1.5×1{0}^{-5}}$=4.2×10-7 mol•L-1,故答案为:4.2×10-7 mol•L-1;
(4)因NaHCO3溶液显碱性,HCO3-的水解程度大于自身的电离程度,即NaHCO3溶液中既存在电离平衡为HCO3-?CO32-+H+,水解平衡为HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度,
故答案为:>;因为NaHCO3溶液中既存在电离平衡:HCO3-?CO32-+H+,又存在水解平衡:HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度.
点评 本题考查了盖斯定律的应用、原电池和电解池原理、平衡常数的计算,正确推断电解池阴阳极是解本题关键,根据加入水溶液的溶质确定电极产物,结合电极产物确定阴阳极,再结合转移电子守恒进行有关计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4----腐蚀品 | B. | CH4---易燃液体 | ||
| C. | 白磷---易自燃物品 | D. | HClO---氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 太阳能不能直接转化为电能 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能等为人类所用 | |
| D. | 绿色植物发生光合作用时,将太阳能转化为化学能“贮存”起来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
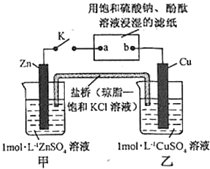
| A. | Cu 电极上发生还原反应 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | 片刻后甲池中 c(SO42-)增大 | D. | 片刻后可观察到滤纸 b 点变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com