
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂.亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g).
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K1 , K2 , K3之间的关系为K3= .
(2)T℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
序号 | c(ClNO)/molL﹣1 | v/molL﹣1s﹣1 |
① | 0.30 | 3.6×10﹣8 |
② | 0.60 | 1.44×10﹣7 |
③ | 0.90 | 3.24×10﹣7 |
n=;k=(注明单位).
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A: 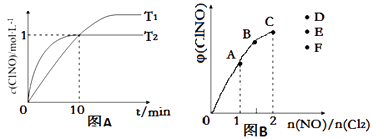
①温度为T1时,能作为该反应达到平衡的标志的有;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随 ![]() 的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的点.
的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的点.
【答案】
(1)![]()
(2)2;4.0×10﹣7mol﹣1?L?s﹣1
(3)bdf;0.05mol?L﹣1?min﹣1;2L/mol
(4)C;F
【解析】解:(1)将方程式2②﹣①得方程式③,则K3= ![]() ,所以答案是:
,所以答案是: ![]() ;(2)
;(2) ![]() =
= ![]() ,n=2,将n代入①中得k=
,n=2,将n代入①中得k= ![]() mol﹣1Ls﹣1=4.0×10﹣7 mol﹣1Ls﹣1 ,
mol﹣1Ls﹣1=4.0×10﹣7 mol﹣1Ls﹣1 ,
所以答案是:2;4.0×10﹣7 mol﹣1Ls﹣1;(3)①a.恒容条件下,容器体积始终保持不变,不能据此判断平衡状态,故错误;
b.反应前后气体的物质的量减小,压强越小,当容器压强保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
c.化学平衡常数只与温度有关,温度不变化学平衡常数不变,不能据此判断平衡状态,故错误;
d.只有氯气有色,当气体颜色保持不变,正逆反应速率相等,反应达到平衡状态,故正确;
e.v(ClNO)=v(NO)时,反应方向未知,无法确定是否达到平衡状态,故错误;
f.NO与 ClNO的物质的量比值保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选bdf;②v(ClNO)= ![]() =0.1mol/(L.min),同一时间段内各物质的反应速率之比等于其计量数之比,据此得v(Cl2)=
=0.1mol/(L.min),同一时间段内各物质的反应速率之比等于其计量数之比,据此得v(Cl2)= ![]() v(ClNO)=
v(ClNO)= ![]() ×0.1mol/(L.min)=0.05mol/(L.min),
×0.1mol/(L.min)=0.05mol/(L.min),
所以答案是:0.05 molL﹣1min﹣1;③开始c(NO)= ![]() =2mol/L、c(Cl2)=
=2mol/L、c(Cl2)= ![]() =1mol/L,
=1mol/L,
该反应中
2NO(g)+ | Cl2(g) | 2ClNO(g) | ||
开始(mol/L) | 2 | 1 | 0 | |
反应(mol/L) | 1 | 0.5 | 1 | |
平衡(mol/L) | 1 | 0.5 | 1 |
化学平衡常数K= ![]() =
= ![]() L/mol=2L/mol,
L/mol=2L/mol,
所以答案是:2L/mol;(4)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,
所以答案是:C;F.
【考点精析】掌握化学平衡的计算是解答本题的根本,需要知道反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s 的平均速率v(PCl3)=0.0032 molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2 , 反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2 , 达到平衡时,PCl3 的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学生设计了如图所示的实验方案: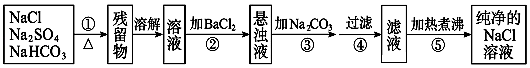
已知碳酸氢钠在加热条件下能分解成碳酸钠、二氧化碳和水,而NaCl和Na2SO4固体加热时不发生化学变化.请回答下列问题:
(1)操作①盛放药品可选用(填仪器名称).
(2)操作②为什么不用Ba(NO3)2溶液,其理由是: .
(3)进行操作②后,判断SO42﹣已除尽的方法是: .
(4)操作③的目的是: .
(5)此设计方案是否严密(填“是”或“否”)理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.126C和146C是2种核素,他们互称同位素
B.近期化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与C60互称同素异形体
C.![]() 与
与  互为同分异构体
互为同分异构体
D.硝基苯可看成是由 ![]() 和﹣NO2两种基团组成
和﹣NO2两种基团组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( ) 
A.从反应开始至a 点,ν(CO2)=0.9 molL﹣1min﹣1
B.曲线Ⅰ对应的条件改变可能是减小压强
C.曲线Ⅱ对应的条件改变可能是充入氢气
D.该温度下,此反应的化学平衡常数的数值为0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关药品的保存和使用不正确的是( )
A.溴水盛于带磨砂玻璃塞的细口瓶中
B.硫酸铜粉末、氯化钙等药品贮存于干燥器中
C.白磷需浸入水中密封保存
D.用碳酸钠滴定盐酸时,Na2CO3液应盛于酸式滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.01molL﹣1HA溶液中逐滴加入0.02molL﹣1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( ) 
A.HA的电离方程式为:HA=H++A﹣
B.MOH为一元弱碱
C.K点对应的溶液中有:c(MOH)+c(M+)=0.02molL﹣1
D.N点对应的溶液中有:c(M+)=c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:![]()
(1)判断BaCl2已过量的方法是。
(2)第⑥步中,相关的离子方程式是。
(3)为检验精盐纯度,需配制230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为 , 需要的玻璃仪器有量筒、 。
(4)配制NaCl(精盐)溶液时,若出现下列操作,造成结果偏低的是。
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀时,液面下降又加水 D.定容时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com