
| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
分析 A.容量瓶用于配制一定物质的量浓度溶液,不能溶解或稀释药品;
B.氯化钠溶于水后电离出钠离子和氯离子;
C.得电子的反应物作氧化剂,氧化剂的氧化性与得电子难易程度有关;
D.HCl是强电解质、醋酸是弱电解质,电解质溶液导电能力与离子浓度成正比.
解答 解:A.容量瓶用于配制一定物质的量浓度溶液,不能溶解或稀释药品,配制一定物质的量浓度溶液时,需要先将药品在烧杯中稀释或溶解,然后冷却至室温后再转移到容量瓶中配制溶液,故A错误;
B.氯化钠溶于水后电离出钠离子和氯离子,钠离子和氯离子和水生成水合钠离子和水合氯离子,故B正确;
C.得电子的反应物作氧化剂,氧化剂的氧化性与得电子难易程度有关,与得电子多少无关,故C错误;
D.HCl是强电解质、醋酸是弱电解质,电解质溶液导电能力与离子浓度成正比,物质的量浓度相同的醋酸和盐酸,盐酸中氢离子浓度大于醋酸,所以相同浓度的盐酸和醋酸,盐酸导电能力大于醋酸,故D错误;
故选B.
点评 本题考查较综合,涉及仪器的使用、电解质的电离、氧化性强弱比较、溶液导电能力影响因素等知识点,易错选项是CD,溶液导电能力与离子浓度成正比与电解质强弱无关,氧化剂的氧化性强弱与得电子难易程度有关,与得电子多少无关,题目难度不大.


科目:高中化学 来源: 题型:解答题
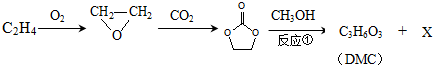
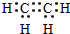 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解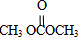

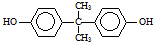 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: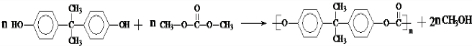 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
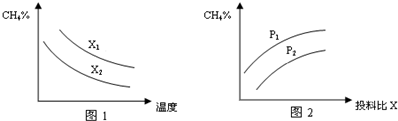
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 氧化还原反应中所有元素的化合价都发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
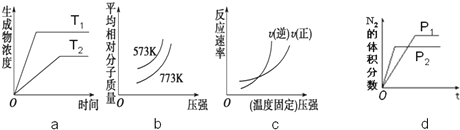
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HC的电离度最大 | |
| B. | HA溶液酸性最强 | |
| C. | HC溶液酸性最强 | |
| D. | 三种溶液中酸的电离程度:HA<HB<HC |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com