
科目:高中化学 来源: 题型:选择题
| A. | 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度 | |
| B. | 在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05mol•L-1下降到0.03 mol•L-1,该双氧水在这2h中分解的平均反应速率约为0.015 mol•L-1•h-1 | |
| C. | 其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢 | |
| D. | 一定条件下,固定体积的容器中发生反应A(g)+B(g)?2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应一定处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X3Y | B. | X3Y2 | C. | X2Y3 | D. | XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
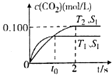 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:| 容器编号 | 起始物质的量 | 平衡时物质的量 |
| Ⅰ | 2.0mol NO,2.0mol CO | 1.0mol CO2 |
| Ⅱ | 4.0mol NO,4.0mol CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应 | 铝 | 镁 |
| A | 与非金属 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
| B | 与水 | 能与沸水反应 | 反应很困难 |
| C | 与碱 | 能溶于强碱溶液 | 不反应 |
| D | 与某些氧化物 | 能与Fe2O3、MnO2、Cr2O3等 金属氧化物发生铝热反应 | 能在CO2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1mol甲基(-CH3)中,电子总数9NA | |
| B. | 在1mol的Na2O2中,有2NA个阴离子 | |
| C. | 标准状况下,22.4L CHC13所含有的分子数目为NA | |
| D. | Cu、A1为电极,浓硝酸为电解质溶液所构成的原电池中,导线上流过NA个电子,则A1电极放出气体的体积一定为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com