
【题目】下列有关说法中不正确的是( )
A.工业上可利用海水制取镁
B.从海产品(如海带等)中提取碘是工业上获取碘的重要途径
C.工业上可通过铝土矿获得铝
D.工业上用CO氧化赤铁矿(含Fe2O3)获得铁
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。化合物R是由A、D两元素形成的离子化合物,其中A+阳离子与Dn-阴离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为______________,在CB3分子中C元素原子的原子轨道发生的是______杂化。
(2)C的氢化物的空间构型为________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________________________________________________________。
(3)B元素的电负性____D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:________________________________。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为_________________。(阿伏加德罗常数用NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
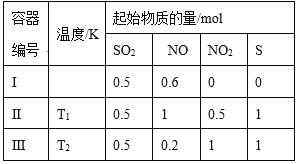
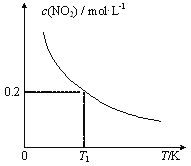
A. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
B. 该反应的ΔH>0
C. T1时,该反应的平衡常数为![]()
D. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
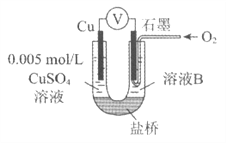
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是__________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:![]() ,下列有关推断正确的是( )
,下列有关推断正确的是( )
A. 这五种元素均为主族元素
B. Nh的最高价氧化物是一种典型的两性氧化物
C. Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
D. Og在通常状况下呈气态,其余四种为固态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,试回答下列问题:
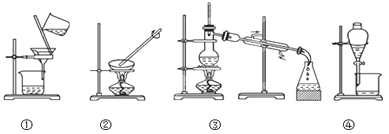
(1)图中③实验操作的名称是__________________;
(2)写出装置④中所用玻璃仪器的名称____________________,____________________;
(3)下列实验需要在哪套装置中进行(填序号):
a、从海水中提取蒸馏水:____________,
b、分离氯化钠和水:________________,
c、分离碳酸钙和水:________________,
d、分离植物油和水:________________;
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质或应用的说法正确的是( )
A.晶体硅是半导体,故在通信工程中用于制光导纤维
B.氧化镁的熔点高,可作优质的耐高温材料
C.液氨汽化放出大量的热,可用作制冷剂
D.明矾具有强氧化性,常用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)。
实验序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
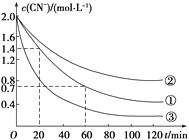
(2)实验①中20~60 min时间段反应速率:v(CN-)=______mol·L-1·min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是____________________(填一点即可)。在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO,同时放出NH3,试写出该反应的离子方程式:____________。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他们设计实验并验证上述结论,完成下表中内容(已知:废水中的CN-浓度可用离子色谱仪测定) ______。
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A. 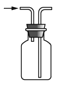 收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C. 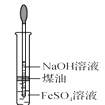 制备 Fe(OH)2D.
制备 Fe(OH)2D.  稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com