
【题目】某同学设计了如图所示的实验装置探究将SO2、Cl2同时通入水中发生的反应。

(1)H装置中主要发生的离子方程式为__,I仪器的作用是__。
(2)若H中Cl2和SO2恰好完全反应,为了检验溶液中的阴离子,补充完整实验操作,并写出结论:取少量H中溶液于洁净的试管中,__。
【答案】Cl2+SO2+2H2O=4H++2Cl-+SO42- 防止倒吸 向其中加入过量的Ba(NO3)2溶液,产生白色沉淀则含有SO42-,过滤后取少量滤液,加入AgNO3溶液,产生白色沉淀,加入稀硝酸后沉淀不消失则含有Cl-
【解析】
(1)H装置中主要的反应是氯气和二氧化硫在溶液中生成盐酸和硫酸,根据SO2易溶于水分析;
(2)若H中Cl2和SO2恰好完全反应,溶液的阴离子为Cl-、SO42,根据银离子对硫酸根离子的干扰分析。
(1) H装置中主要反应的离子方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42,SO2易溶于水;I仪器的作用是防倒吸;
(2)若H中Cl2和SO2恰好完全反应,溶液的阴离子为Cl-、SO42,先检验SO42,后检验Cl-,则结论为:取少量H中溶液于洁净的试管中,向其中加入过量的Ba(NO3)2溶液,产生白色沉淀则含有SO42-,过滤后取少量滤液,加入AgNO3溶液,产生白色沉淀,加入稀硝酸后沉淀不消失则含有Cl-。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】某小组同学用图所示装置制取氨,并探究其性质。
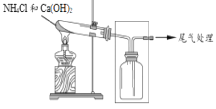
(1)制取氨气的化学方程式是______。
(2)采用图示的方法收集氨气,是因为氨气的密度比空气 ______(填“大”或“小”)。
(3)将蘸有浓盐酸的棉球放在玻璃片上,用集满NH3的集气瓶扣住棉球,可观察到的现象是______。
(4)甲同学设计了下图所示的装置进行尾气处理,乙同学认为该设计不合理,请画出正确的尾气吸收图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
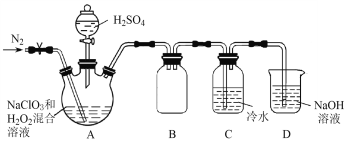
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_______________________________。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________________作指示剂,用0.100 0 mol![]() L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol
L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol![]() L-1。
L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)从开始至2min,X的平均反应速率为__________;
(2)该反应的化学方程式为_______________________;
(3)1min时,正逆反应速率的大小关系为:v(正)_____v(逆),2min时,v(正)_____v(逆)。(填“>”或“<”或“=”)
(4)若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,X的化学反应速率将______,若加入适合的催化剂,Y的化学反应速率将______。(填“变大”或“不变”或“变小”)
(5)若X、Y、Z均为气体,下列能说明反应已达平衡的是_____________。
a.X、Y、Z三种气体的浓度相等
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=2:1
e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热播电视剧《破冰行动》中曾经多次提到一种叫东莨菪碱(Scopolamine)的化学物质。东莨菪碱是1892年由E.施密特首先从东莨菪中分离出来,可用于麻醉、镇痛、止咳、平喘,对动晕症有效。但其毒性较强,稍一过量服用即可致命,具有极高的致幻作用,称为“魔鬼呼吸”。其结构如下图,下列说法不正确的是( )
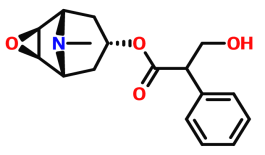
A. 分子间可以形成分子间氢键
B. 东莨菪碱的化学式为C17H21NO4
C. 该物质能发生加成、取代和氧化反应
D. 可使用质谱仪测出这个分子的相对分子质量,也可用核磁共振氢谱确定这个分子的环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用甲醇燃料电池进行如下电解实验,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法不正确的是

A. 甲池中通入CH3OH的电极反应:CH3OH-6e-+8OH-=CO32-+6H2O
B. 甲池中消耗560mLO2(标准状况下),理上乙池Ag电极增重3.2g
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D. 丙池右侧Pt电极的电极反应式:Mg2++2H2O+2e-=Mg(OH)2↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示用酸性氢氧燃料电池为电源进行的电解实验。下列说法中正确的是( )
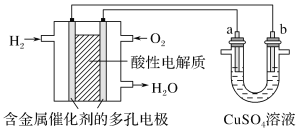
A. 燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,a极上产生的O2与电池中消耗的 H2体积比为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸
C.![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
D.有机物![]() 分子中所有碳原子不可能在同一个平面上
分子中所有碳原子不可能在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的基态原子的核外电子有3种能量状态、5种空间状态,X是其中第一电离能最小的元素;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。
(1)X基态原子的电子排布式为___________。
(2)X的氢化物(H2X)在乙醇中的溶解度大于H2Y,其原因是___________。
(3)在Y的氢化物(H2Y分子中,Y原子轨道的杂化类型是___________。
(4)Y与X可形成YX32-。
①YX32-的立体构型为___________(用文字描述)。
②写出一种与YX32-互为等电子体的分子的化学式___________。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离子中的配体是___________(写化学式)。

(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___________。其晶胞边长为540.0pm,密度为___________g·cm-3(列式并计算),a位置Y与b位置Z之间的距离为___________pm(列式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com