
| 欲提纯物质与杂质 | 所选试剂 |
| Fe (Al) | |
| Al2O3(Al) | |
| FeCl2 (FeCl3) | |
| FeCl3 (FeCl2) | |
| SiO2 (CaCO3) |
分析 (1)铝可与NaOH溶液反应而铁与氢氧化钠不反应;铝氧化成氧化铝;FeCl3具有氧化性,能与还原性铁粉反应生成FeCl2;FeCl2具有还原性,被氯气氧化成氯化铁;SiO2不与酸反应等物质的性质进行分离.
(2)根据n=$\frac{N}{{N}_{A}}$计算出氨气分子的物质的量,然后根据氨气的分子式计算出含有氢离子的物质的量;
(3)根据n=cV,氢氧化钡是二元强碱,氢氧根离子的浓度是氢氧化钡的2倍,钡离子的浓度等于氢氧化钡的浓度;
解答 解:(1)Fe 中含有Al,加入NaOH溶液;Al2O3中含杂质Al,用加热的方法将铝转化为氧化铝;FeCl2 中含杂质FeCl3,加入还原性铁粉,将铁离子还原成亚铁;FeCl3 中含杂质FeCl2,加新制氯水将亚铁氧化成铁离子;SiO2 中含有CaCO3,加盐酸将碳酸钙转化为氯化钙溶液,故答案为:
| 欲提纯物质与杂质 | 所选试剂 |
| Fe (Al) | C |
| Al2O3(Al) | E |
| FeCl2 (FeCl3) | A |
| FeCl3 (FeCl2) | B |
| SiO2 (CaCO3) | D |
点评 本题综合考查物质的分离以及药品的储存等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
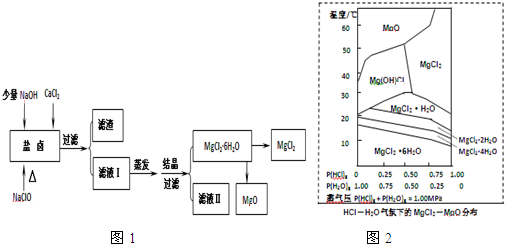
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
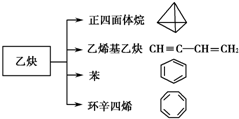 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| B. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| C. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| D. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. |  和 和 互为同系物 互为同系物 | |
| C. | Na2SO3和H2O2的反应为氧化还原反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子818O | B. | 乙烯的结构简式为:C2H4 | ||
| C. | CH4分子的比例模型: | D. | -CH3(甲基)的电子式为: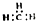 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com