
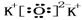 .
.分析 A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA2、BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,结合原子序数可知,D为K、C为Cl,据此解答.
解答 解:A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,结合原子序数可知,D为K、C为Cl,
①D为K元素,在元素周期表中的位置是:第四周期第ⅠA族,故答案为:第四周期第ⅠA族;
②A与D所形成的化合物为K2O,电子式为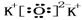 ,故答案为:
,故答案为: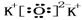 ;
;
③将氯气的水溶液滴加到K2S的水溶液中,硫离子被氧化生成硫,氯气被还还原,同时生成KCl,反应的化学方程式为:Cl2+K2S=2KCl+S↓,
故答案为:Cl2+S2-=2Cl-+S↓.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
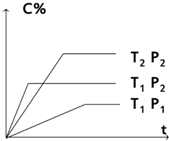 对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,
对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O2是氧化剂,H2O2中的氧元素被还原 | |
| B. | 每生成1 mol O2转移的电子的物质的量为2 mol | |
| C. | ClO2中的氯元素被氧化 | |
| D. | ClO2是氧化剂,H2O2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱溶液清除灶具上的油污 | |
| B. | 用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ | |
| C. | 用硫酸清洗锅炉中的水垢 | |
| D. | 用明矾[KAl(SO4)2•12H2O]作净水剂,除去水中悬浮的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 开始蒸馏时,应该先通冷凝水,再加热;蒸馏完毕,应该先撤酒精灯再停通冷凝水 | |
| C. | 使用托盘天平称量物质时,先取小砝码,再依次取较大的砝码 | |
| D. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
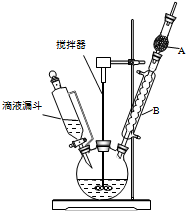 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇[ | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
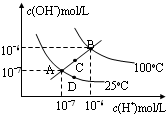
| A. | 图中四点Kw间的关系:A=D<C<B | |
| B. | 若从A点到D点,可采用:温度不变在水中加少量酸 | |
| C. | 若从A点到C点,可采用:温度不变在水中加少量NaAc固体 | |
| D. | 若从A点到D,可采用:温度不变在水中加少量NaAc固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量错误 | |
| B. | H2O2分解不完全 | |
| C. | Na2O2转化为Na0H和H2O2的反应不完全 | |
| D. | 装置漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com