
【题目】为提纯下列物质(括号内为杂质),选用的除杂试剂和分离方法都正确的是
选项 | 物质 | 除杂试剂 | 分离方法 |
A | 二氧化硅(碳酸钙) | 氢氧化钠溶液 | 过滤 |
B | 硫酸铜溶液(硫酸铁) | 加入过量铜粉 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | SO2(CO2) | 碳酸钠溶液 | 洗气 |
A. AB. BC. CD. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
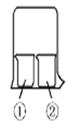
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2+H2O![]() HS+OH。下列说法正确的是( )
HS+OH。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 升高温度,c(HS)/c(S2)增大
C. 加入NaOH固体,溶液pH减小
D. 通入CuSO4固体,HS浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1mol/LNa2CO3溶液:c(OH-)=c(H2CO3)+c(HCO3-)+c(H+)
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):
试回答:
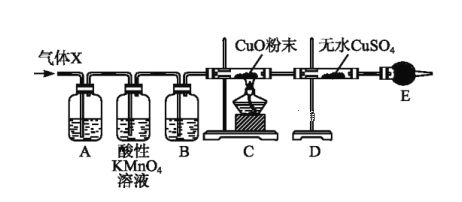
(1)上述实验中生成二氧化硫气体的化学方程式为_________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)丙同学在安装好装置后,必不可少的一步操作是__________。
(4)B中加入的试剂是______,其作用是___________。
(5)可以证明气体X中含有氢气的实验现象是;C中______,D中______。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?___________
为什么?_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
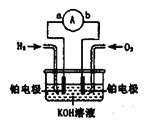
(1)氢氧燃料电池的能量转化形式主要是_______,在导线中电子流动方向为_____(用a、b和箭头表示)。
(2)负极反应式为__________。
(3)电极表面镀铂粉的原因为__________ 。
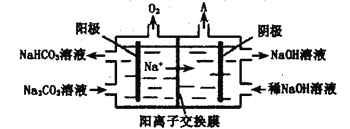
(4)使用上述电池电解(均为Pt电极)一定浓度的Na2CO3溶液,原理如下图所示。阳极的电极反应式为___________。
(5)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解泄中隔膜可阻止气体通过,阴、阳极均为惰性电极)。
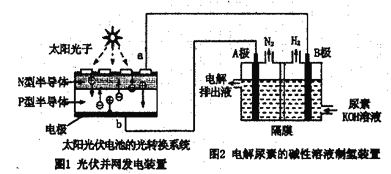
①图1中N型半导体为________(填“正极”或“负极”)。该系统工作时,A极的电极反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,若A极产生7.00gN2,则此时B极产生_____LH2(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
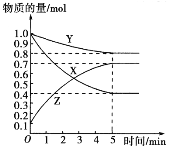
(1)由图中的数据分析,该反应的化学方程式为_________ 。
(2)5 min内用Z表示的平均反应速率为_______________。
(3)化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌代替纯锌和稀硫酸反应,这是利用_____________________原理加快了氢气生成的速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com