
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
分析 可逆反应A(s)+3B(g)?2C(g)+D(g)达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,据此分析解答.
解答 解:A.该反应中A为固态,反应前后气体的质量发生变化,该容器容积不变,根据ρ=$\frac{m}{V}$可知,反应过程中密度发生变化,当密度不变时,表明正逆反应速率相等,该反应达到平衡状态,故A正确;
B.3v正(B)=v逆(D),表示的是正逆反应速率,但是不满足化学计量数关系,说明没有达到平衡状态,故B错误;
C.D的物质的量分数在混合气体中保持不变,表明正逆反应速率相等,该反应已经达到平衡状态,故C正确;
D.B、C、D的分子个数之比为3:2:1,无法判断各组分的浓度是否变化,则无法判断平衡状态,故D错误;
故选AC.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,选项A为易错点,注意该反应中A的状态为固态,试题有利于提高学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
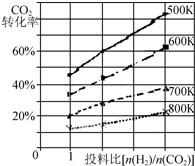 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
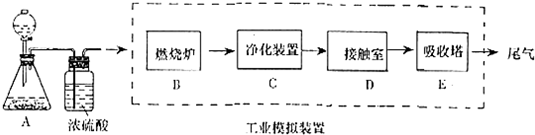
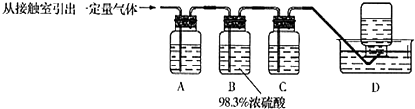
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的最高正化合价等于它所处的族序数 | |
| B. | 主族族序数与价电子数相同 | |
| C. | 非金属元素在化合物中既可显正价又可显负价 | |
| D. | 所有非金属元素的负化合价等于使原子达到8电子稳定结构所需得到的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
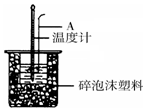 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com