
| A. | S$\stackrel{O_{2}、点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}溶液}{→}$BaSO3 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 |
分析 A.二氧化硫与水反应生成亚硫酸;
B.二氧化硫与氯化钡不反应;
C.氯化铁溶液蒸发生成氢氧化铁;
D、二氧化硅与氢氧化钠反应生成硅酸钠和水、硅酸钠与盐酸反应生成硅酸.
解答 解:A.二氧化硫与水反应生成亚硫酸,亚硫酸与氧气反应才生成硫酸,故A错误;
B.二氧化硫与氯化钡不反应,二氧化硫与氢氧化钡反应可以生成亚硫酸钡,故B错误;
C.氯化铁溶液蒸发生成氢氧化铁,氯化铁溶液在氯化氢氛围中蒸发生成无水氯化铁,故C错误;
D.二氧化硅与氢氧化钠反应生成硅酸钠和水、硅酸钠与盐酸反应生成硅酸,均实现各步转化,故D正确;
故选D.
点评 本题考查了物质性质、物质转化的应用,主要是硫、硅、铁的化合物性质的理解判断,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
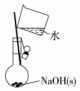
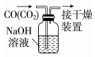
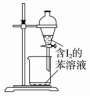
| A.配制0.10mol•L-1 NaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.定容 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: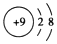 | |
| B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | S2-的结构示意图: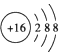 | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
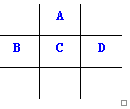 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: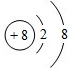 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
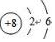 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示) _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和NO2是主要的大气污染物 | |
| B. | 大气中的SO2和CO2溶于水形成酸雨 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 对煤燃烧后形成的烟气脱硫,目前主要用石灰法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
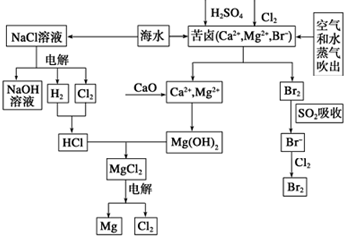 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com