

| 数据 次数 | 1 | 2 | 3 |
| 初始读数 | 2.00 | 12.50 | 5.20 |
| 最后读数 | 27.10 | 37.40 | 33.20 |
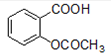 ,其含有的官能团为羧基和酯基;
,其含有的官能团为羧基和酯基; 中含有的官能团为羧基和酯基,故答案为:羧基;
中含有的官能团为羧基和酯基,故答案为:羧基; +H2O
+H2O | 稀硫酸 |
| △ |
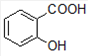 +CH3COOH,
+CH3COOH, +H2O
+H2O | 稀硫酸 |
| △ |
 +CH3COOH;
+CH3COOH;| (24.90+25.10)×10-3L |
| 2 |
| (24.90+25.10)×10-3L |
| 2 |
| (24.90+25.10)×10-3L |
| 2 |
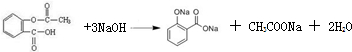 可知,乙酰水杨酸的含量为:
可知,乙酰水杨酸的含量为:0.1015mol/L×50.00×10-3L-0.1015mol/L×
| ||
| 3 |
0.1015mol/L×50.00×10-3L-0.1015mol/L×
| ||
| 3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、气态氢化物的热稳定性:A<C |
| B、元素A与B只能形成一种化合物 |
| C、最高价氧化物对应的水化物的酸性:C>D |
| D、原子半径的大小顺序:rB>rC>rD>rA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中XZ的物质的量浓度随时间变化的曲线.
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中XZ的物质的量浓度随时间变化的曲线.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钾、碳酸钙、碳酸氢钙都属于可溶性的碳酸盐 |
| B、二氧化硫、五氧化二磷、乙醇都属于氧化物 |
| C、氢氧化钡、氢氧化钾、纯碱都属于碱 |
| D、盐酸、硝酸、乙酸都属于一元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2 H2O2
| ||||
| B、FeO+2 HCl═FeCl2+H2O | ||||
| C、KOH+HNO3═KNO3+H2O | ||||
| D、CuCl2+2 NaOH═Cu(OH)2↓+2 NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com