
【题目】根据要求,用化学用语表示下列有关反应:
(1)用KOH溶液作电解质,Pt作电极,氢氧燃料电池中正极的电极反应式:___________________
(2)向含Cu2+的废水中加入FeS固体,除去Cu2+的离子方程式:____________________________
(3)用CO气体还原1molFe2O3固体,放热24.8kJ,该反应的热化学方程式:_________________
(4)向漂白粉中加入盐酸产生有毒气体,用化学方程式表示反应原理:____________________
(5)用石墨作电极电解饱和食盐水,写出电解的化学方程式:________________________
【答案】 O2+2H2O+4e-=4OH- FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq) 3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1 Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O 2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
【解析】试题分析:(1).用KOH溶液作电解质,Pt作电极,氢氧燃料电池中正极反应是氧气得电子生成氢氧根离子;(2)向含Cu2+的废水中加入FeS固体,生成更难溶的CuS沉淀;(3)用CO气体还原1molFe2O3固体,放热24.8kJ,![]() ;(4)向漂白粉中加入盐酸,次氯酸钙和盐酸反应生成氯气;(5)用石墨作电极电解饱和食盐水生成氢气、氯气、氢氧化钠。
;(4)向漂白粉中加入盐酸,次氯酸钙和盐酸反应生成氯气;(5)用石墨作电极电解饱和食盐水生成氢气、氯气、氢氧化钠。
解析:(1).用KOH溶液作电解质,Pt作电极,氢氧燃料电池中正极是氧气得电子生成氢氧根离子,正极的电极反应式是O2+2H2O+4e-=4OH-;
(2)向含Cu2+的废水中加入FeS固体,生成更难溶的CuS沉淀,反应的离子方程式是FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq);
(3)用CO气体还原1molFe2O3固体,放热24.8kJ,![]() ,热化学方程式是3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1;
,热化学方程式是3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1;
(4)向漂白粉中加入盐酸,次氯酸钙和盐酸反应生成氯气,反应方程式是Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O;
(5)用石墨作电极电解饱和食盐水生成氢气、氯气、氢氧化钠,反应总方程式是2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH。
H2↑+Cl2↑+2NaOH。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. Fe3O4 溶于足量氢碘酸:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
B. 用石墨作电极电解AlC13溶液:2Cl–+2H2O![]() H2↑+ Cl2↑+2OH–
H2↑+ Cl2↑+2OH–
C. 澄清的石灰水中加入少量的 NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O
D. 向含1mol FeBr2的溶液中通入0.6mol Cl2:10Fe2+ + 4Br+ 8Cl2 = 10Fe3+ + 2Br2 + 16Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知等浓度的NaX、NaY 、NaZ三种溶液的pH:10、9、8,则由此可判断下列叙述正确的是( )
A.HX > HY > HZB.HX < HY < HZ
C.HZ > HX > HYD.HX > HZ > HY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: 
(1)葡萄糖摩尔质量为 , 其中碳、氢、氧三种元素的质量比为;
(2)该注射液中葡萄糖的物质的量浓度为mol/L(保留两位小数);
(3)实验室配制100mL该浓度的葡萄糖溶液需要用托盘天平称取葡萄糖粉末g,需要的主要玻璃仪器有量筒、烧杯、胶头滴管、、等;
(4)下列说法不正确的是(填序号) ①使用容量瓶前检查它是否漏水
②定容时仰视刻度线,所配溶液浓度偏大
③定容时加水超过刻度线,把水倒出一些,重新加水至刻度线
④定容后塞好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转摇匀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃的水溶液中,AgCl、AgBr、AgI均难溶于水,且Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=1.0×10-12,Ksp(AgI)=8.7×10-17;
(1)若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)_______________。(填“增大”、“减小”或“不变”)。
(2)在25℃时,若取0.188g的AgBr(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为_____________。
(3)①由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化_______(填“能”或“否”),简述理由:_____________________________________________________________。
②若某KCl溶液的浓度为1.0×10-2mol·L-1,将等体积的该KCl溶液与AgNO3溶液混合,则生成沉淀所需AgNO3溶液的最小浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.电子气理论可以解释金属晶体锗的延展性,导电性和导热性
B.晶体与非晶体的本质区别是晶体有规则的几何外形而非晶体没有
C.晶体从岩浆晶出时晶格能高的晶体先结晶。
D.离子晶体中离子的配位数不同只与阴阳离子的半径比有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( ) 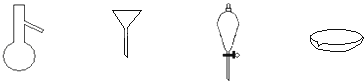
A.蒸馏、蒸发、萃取、过滤
B.蒸馏、过滤、萃取、蒸发
C.萃取、过滤、蒸馏、蒸发
D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com