
| A. | 漂白粉 | B. | 漂白液 | C. | 臭氧 | D. | SO2 |
科目:高中化学 来源: 题型:解答题

 ,由A生成F的反应类型是加聚反应.
,由A生成F的反应类型是加聚反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeC13溶液中:A13+、NH4+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、K+、SO42-、NO3- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-15mol/L的溶液中:Na+、Fe3+、I-、AlO2- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是一样的 | |
| C. | MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
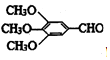 )和抗癫痫药物H(
)和抗癫痫药物H(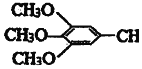 =CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):
=CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):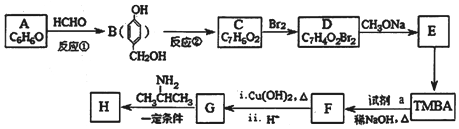
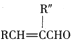 (R、R″表示烃基或氢)
(R、R″表示烃基或氢)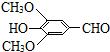 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O.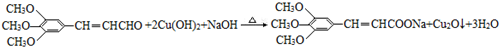 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.
物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K +、.MnO 4 -、Cl -、SO 4 2- | B. | Na +、CO 3 2-、Cl -、SO 4 2- | ||
| C. | NO 3 -、Na +、HCO 3 -、Ba 2+ | D. | Na +、NO 3 -、NH 4 +、SO 4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
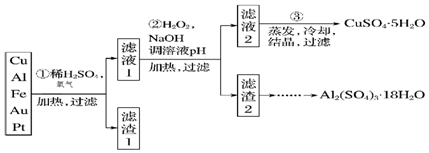
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素的非金属性次序为c>b>a | |
| B. | a-的还原性弱于c-的还原性 | |
| C. | d和其他3种元素均能形成离子化合物 | |
| D. | 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com