
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
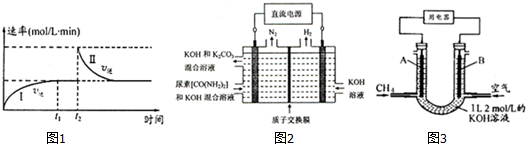
分析 (1)a.0~t1时,逆反应速率增大,反应向正反应进行,t2时改变条件,逆反应速率减小,反应向逆反应进行;
b.混合气体的密度始终不变;
c.t2时刻若向密闭容器中加C,平衡逆向移动,反应前后气体的体积不变,恒温恒容下平衡时物质的浓度与原平衡相同;
d.平衡常数只受温度影响,若是升高温度使平衡逆向移动,平衡时的反应速率应高于原平衡;
(2)①根据v=$\frac{\frac{△n}{V}}{△t}$计算υ (CO2 );
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,与起始投入的二氧化碳与氨气的物质的量之比均为1:4,等效为在原平衡的基础上增大压强,平衡正向移动;
③平衡时二氧化碳为0.02mol,计算平衡时各组分的物质的量浓度,代入平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$计算;
④电解尿素〔CO(NH2)2〕的碱性溶液制取氢气,由图可知,阳极上是尿素失去电子,碱性条件下生成氮气、碳酸根离子,还有水生成;
(3)V(甲烷)=44.8L,则n(甲烷)=2mol,而KOH为1L×2mol/L=2mol,二者物质的量之比为1:1,故反应生成碳酸氢钾与水.
解答 解:(1)a.0~t1时,逆反应速率增大,反应向正反应进行,则v正>v逆,t2时改变条件,逆反应速率减小,反应向逆反应进行,t2时,v逆>v正,故a正确;
b.混合气体总质量不变,反应前后气体的物质的量不变,恒温条件下,容器的容积不变,混合气体的密度始终不变,故b错误;
c.t2时刻若向密闭容器中加C,平衡逆向移动,反应前后气体的体积不变,恒温恒容下平衡时物质的浓度与原平衡相同,反应速率相同,故c正确;
d.平衡常数只受温度影响,若是升高温度使平衡逆向移动,平衡时的反应速率应高于原平衡,而图象为速率相等,故d错误,
故选:ac;
(2)①υ (CO2 )=$\frac{\frac{0.1mol-0.02mol}{2L}}{70min}$=0.00057mol/(L.min),故答案为:0.00057;
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,与起始投入的二氧化碳与氨气的物质的量之比均为1:4,等效为在原平衡的基础上增大压强,平衡正向移动,二氧化碳的转化率增大,故答案为:增大;
③平衡时二氧化碳为0.02mol,则:
CO2(g)+2NH3(g)?CO(NH2)2(1)+H2O(g)
开始(mol):0.1 0.4 0
转化(mol):0.08 0.16 0.08
平衡(mol):0.02 0.24 0.08
平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$=$\frac{\frac{0.08}{2}}{\frac{0.02}{2}×(\frac{0.24}{2})^{2}}$=277.8,
故答案为:277.8;
④电解尿素〔CO(NH2)2〕的碱性溶液制取氢气,由图可知,阳极上是尿素失去电子,碱性条件下生成氮气、碳酸根离子,还有水生成,阳极电极反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(3)V(甲烷)=44.8L,则n(甲烷)=2mol,而KOH为1L×2mol/L=2mol,二者物质的量之比为1:1,故反应生成碳酸氢钾与水,电池总反应方程式为:CH4+2O2+KOH=KHCO3+2H2O,
故答案为:CH4+2O2+KOH=KHCO3+2H2O.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、电化学等,(1)为易错点,学生容易忽略平衡时的速率相等,难度中等.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 4:1 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com