
| A. | CO2H2S | B. | NH3 HCl | C. | P4 CCl4 | D. | C2H4 CH4 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠、镁、铝原子半径依次增大 | B. | NH3H2O HF 稳定性依次减弱 | ||
| C. | H3PO4H2SO4HClO4酸性依次增强 | D. | NaOH Mg(OH)2 Al(OH)3碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠与浓硫酸混合加热:H2SO4(浓)+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO${\;}_{4}^{2-}$+2HCl↑ | |
| B. | 过量的硫化钠溶液与氯化铁溶液反应:2Fe3++S2-═2Fe2++S↓ | |
| C. | 碳酸氢铵溶液与足量NaOH溶液混合后加热:NH${\;}_{4}^{+}$+HCO${\;}_{3}^{-}$+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO${\;}_{3}^{2-}$+NH3↑+2H2O | |
| D. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
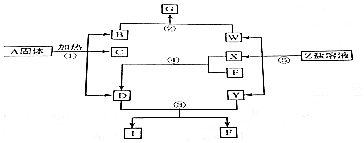
| A. | 化学能转化成机械能在转化成电能 | |
| B. | 化学能转化成热能在转化成电能 | |
| C. | 化学能转化成机械能在转化成热能在到机械能 | |
| D. | 化学能转化成热能在转化成机械能在到电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、Be、B 原子最外层电子数依次增多 | |
| B. | P、S、Cl 元素最高正化合价依次升高 | |
| C. | F2、Cl2、Br2、I2的熔点依次降低 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 将容器体积变为5 L,Z的平衡浓度变为原来的2倍 | |
| C. | Y浓度变化表示的反应速率为0.0005 mol/(L•s ) | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑的现象,说明浓硫酸具有脱水性 | |
| B. | Na的金属活动性比Mg强,说明可用Na与MgCl2溶液反应制Mg | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸反应生成了致密的氧化物 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
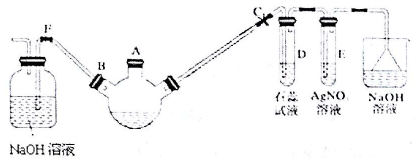
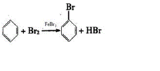 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
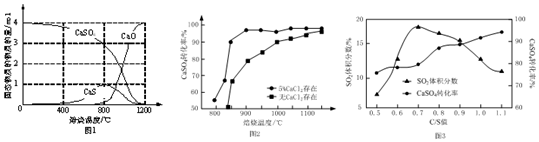
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com