
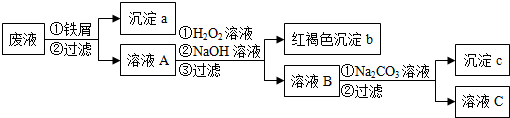
分析 某酸性废液中加入铁粉铁离子、铜离子和氢离子与铁反应生成深沉a是铁与铜,溶液A中含有亚铁离子和钡离子,然后加入过氧化氢将亚铁转化为铁离子,调节溶液PH使铁离子转化为氢氧化铁沉淀完全,所以沉淀b是氢氧化铁,溶液B中含钡离子、钠离子和氢氧根离子,加入碳酸钠生成碳酸钡沉淀,由此分析解答;
(1)加铁屑后发生的离子反应有铁离子、铜离子和氢离子与铁反应;
(2)沉淀a中含有的单质是铁和铜;
(3)沉淀c的化学式是碳酸钡;
(4)H2O2与Fe2+在酸性条件下反应生成铁离子、水.
解答 解:某酸性废液中加入铁粉铁离子、铜离子和氢离子与铁反应生成深沉a是铁与铜,溶液A中含有亚铁离子和钡离子,然后加入过氧化氢将亚铁转化为铁离子,调节溶液PH使铁离子转化为氢氧化铁沉淀完全,所以沉淀b是氢氧化铁,溶液B中含钡离子、钠离子和氢氧根离子,加入碳酸钠生成碳酸钡沉淀,
(1)加铁屑后发生的离子反应有铁离子、铜离子和氢离子与铁反应,所以加铁屑后发生的离子反应有3条,故选:c;
(2)沉淀a中含有的单质是铁和铜,故答案为:铁和铜;
(3)沉淀c的化学式是碳酸钡,所以化学式为:BaCO3,故答案为:BaCO3;
(4)H2O2与Fe2+在酸性条件下反应生成铁离子、水,反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O.
点评 本题考查了铁铜及其化合物的知识,主要利用题给信息,结合流程图和实验目的正确解答.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
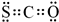 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和AlCl3溶液反应 | B. | 最高价氧化物对应水化物的碱性 | ||
| C. | 单质与H2O反应的难易程度 | D. | 同浓度NaCl和AlCl3溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL0.1 mol•L-1氨水与10 mL0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL0.1 mol•L-1NH4Cl溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL0.1 mol•L-1CH3COOH溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com