
【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。
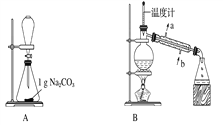
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是___________________,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时。
(2)B装置的冷凝管的主要作用是_____________,可否换为球形冷凝管 (填“可”或“否”)。
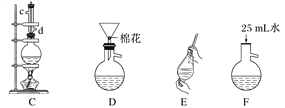
(3)制备和提纯苯甲酸甲酯的操作先后顺序为_______________(填装置字母代号)。
(4)A中Na2CO3的作用是____________________;D装置的作用是___________________
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出
【答案】⑴先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸 冷却后补加
⑵冷凝收集产品 否
⑶CFEADB
⑷除去苯甲酸甲酯中的苯甲酸 除去没有反应完的Na2CO3
⑸ b
【解析】本题考查实验设计方案的评价,(1)根据表格中数据,苯甲酸常温下为固体,因此先加入苯甲酸,然后加入甲醇,最后加入浓硫酸,具体操作是:先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸;加热一段时间,发现忘记加瓷片,需要冷却装置C后,再加入碎瓷片,防止烫伤;(2)装置B中冷凝管是把产物有气体冷却为液体,即冷凝收集产品,此冷凝管不能换为球形冷凝管,产品会残留在球形冷凝管的凹处;(3)装置C是制备苯甲酸甲酯的发生装置,制备的苯甲酸甲酯混有苯甲酸、甲醇和硫酸,应用水洗去可溶于水的物质,,苯甲酸甲酯常温下为液体,然后采用分液的方法进行分离,苯甲酸甲酯中混有苯甲酸和少量乙醇,利用苯甲酸的酸性强于碳酸,用碳酸钠除去苯甲酸,碳酸钠是固体且过量,然后采用过滤方法除去碳酸钠,最后采用蒸馏的方法,得到苯甲酸甲酯,操作的先后顺序是CFEADB;(4)根据(3)的分析,碳酸钠的作用是除去苯甲酸甲酯中的苯甲酸;装置D的作用是:除去没有反应完的Na2CO3;(5)由于苯甲酸甲酯的密度大于水的密度,分液时应从下口流出,上层液体从上口倒出,即选项b正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关药物的知识,说法正确的是( )
A. 麻黄碱是兴奋剂,奥委会严禁运动员使用
B. 药物能防病治病,可以大量使用
C. 胃酸分泌过多,可用氢氧化钠作抗酸药
D. 使用青霉素前,不需进行皮肤敏感试验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.非极性键可能存在单质中,也可能存在化合物中
B.含有离子键的化合物不可能含有非极性键
C.盐酸中含有H+和Cl- , 故HCl为离子化合物
D.含有共价键的化合物不可能是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 7.8g苯所含碳碳双键数目为0.3NA
B. 28g乙烯所含共用电子对数目为6NA
C. 标准状况下,11.2L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置_____________________。
(2)B的原子结构示意图_____________________。
(3)E元素形成最高价氧化物对应水化物的化学式为_____________________。
(4)元素C、D、E形成的原子半径大小关系是_____________________(用元素符号表示).
(5)B、C的气态氢化物的稳定性关系为____________________(填化学式)。
(6)C、D可形成原子个数比为1:1的化合物的电子式是_____________________。
(7)写出A、C、F三种元素按原子个数比1:1:1形成化合物的结构式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丁酸(结构简式为:CH3CH2CH2COOH)跟乙酸具有相似的化学性质,丁醇(结构简式为:CH3CH2CH2CH2OH)跟乙醇具有相似的化学性质:
试回答下列问题:
(1)写出丁醇、丁酸与Na反应的化学方程式:
丁醇+钠:_____________________________________;
丁酸+钠:_____________________________________;
(2)写出丁酸与丁醇的酯化反应的化学方程式,注明反应条件。
______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)(1)用系统命名法给下列有机物命名或写出对应的结构简式。
① _________________
_________________
②![]() _________________
_________________
③1,3,5—三甲苯_________________
(Ⅱ)某工厂废液经测定得知主要含有乙醇,其中还有丙酮和乙酸。根据下表中各物质的性质,按下列步骤回收乙醇和乙酸.
物质 | 丙酮 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 78.5 | 117.9 |
①向废液中加入烧碱溶液,调整溶液的pH=10;
②将混合液放入蒸馏器中缓缓加热;
③收集温度在70℃~85℃时的馏出物;
④排出蒸馏器中的残液,冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,回收馏出物。
请回答下列问题:
(2)加入烧碱使溶液的pH=10的目的是___________________。
(3)在70℃~85℃时馏出物的主要成分是__________________。
(4)黄酮类药物中部分化合物具有很好的药用价值,比如可以降低血管的脆性,改善血管的通透性、降低血脂和胆固醇,用于防治老年高血压和脑溢血。酮类化合物A是黄酮类药物的一中合成中间体,其结构如下:
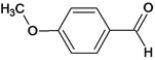
化合物A的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有_______种(已知:酚羟基能与FeCl3溶液发生显色反应,醛基可发生银镜反应),其中核磁共振氢谱为5组峰,且峰面积为2:2:2:1:1的为:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及的有机物及有机反应类型错误的是()
A. 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应
B. 酯、蛋白质、纤维素都能发生水解反应
C. 苯、乙醇和乙酸都能发生取代反应
D. 1 mol乙醇与1mol乙酸在一定条件下,发生酯化反应可生成1mol乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com