
某强酸性溶液X含有Ba2+、Al3+、NH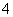 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO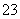 、SO
、SO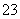 、SO
、SO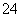 、Cl-、NO
、Cl-、NO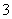 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
【知识点】离子推断B1 D5C5
【答案解析】(1)Al3+、NH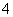 、Fe2+、SO
、Fe2+、SO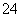

(2)3Fe2++NO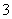 +4H+===3Fe3++NO↑+2H2O
+4H+===3Fe3++NO↑+2H2O
AlO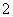 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO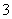
(3)若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等
解析:⑴在强酸性溶液中不可能有CO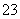 、SO
、SO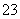 ,溶液X加硝酸钡产生沉淀C(硫酸钡),则说明溶液X中存在SO
,溶液X加硝酸钡产生沉淀C(硫酸钡),则说明溶液X中存在SO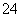 ,不存在Ba2+;生成气体A,则溶液中一定含Fe2+,因为酸性溶液中硝酸根离子具有强氧化性,将Fe2+氧化为Fe3+,则X中没有NO
,不存在Ba2+;生成气体A,则溶液中一定含Fe2+,因为酸性溶液中硝酸根离子具有强氧化性,将Fe2+氧化为Fe3+,则X中没有NO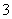 ,得到的气体A为NO,D为NO2,E为HNO3;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+,生成的沉淀G是Fe(OH)3,与碱反应生成的气体F为NH3,溶液H通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-,则原溶液中一定含有Al3+,沉淀I为Al(OH)3。因此原溶液中一定含有Al3+、NH4+、Fe2+、SO42-。
,得到的气体A为NO,D为NO2,E为HNO3;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+,生成的沉淀G是Fe(OH)3,与碱反应生成的气体F为NH3,溶液H通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-,则原溶液中一定含有Al3+,沉淀I为Al(OH)3。因此原溶液中一定含有Al3+、NH4+、Fe2+、SO42-。
⑵步骤①的反应是在酸性条件下NO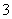 氧化Fe2+:3Fe2++NO
氧化Fe2+:3Fe2++NO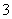 +4H+===3Fe3++NO↑+2H2O,步骤②是过量二氧化碳和偏铝酸钠溶液的反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-。
+4H+===3Fe3++NO↑+2H2O,步骤②是过量二氧化碳和偏铝酸钠溶液的反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-。
⑷由于A(NO)、F(NH3)、I(Al(OH)3)均为0.1mol,可知原溶液中n(Al3+)=0.1mol;n(NH4+)=0.1mol,依据电子守恒可知3Fe2+~NO;n(Fe2+)=0.3mol;10mLX溶液中n(H+)=0.4mol,沉淀C(BaSO4)物质的量为0.7mol,则n(SO42-)=0.7mol,依据溶液中电荷守恒得到:正电荷=2c(Fe2+)+3c(Al3+)+c(NH4+)+c(H+)=2×0.3+3×0.1+0.1+0.4=1.4mol;负电荷=2[SO42-]=2×0.7=1.4mol,刚好相等,因此若检验Fe3+肯定存在时,就有Cl-存在。
【思路点拨】本题是根据离子共存关系判断离子的存在,在解题时需注意有没有引入X中所含离子,如步骤①就引入NO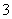 ,则A气体不一定X中的NO
,则A气体不一定X中的NO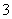 参与反应得到的,定量计算时可根据电荷守恒判断离子的存在。
参与反应得到的,定量计算时可根据电荷守恒判断离子的存在。


科目:高中化学 来源: 题型:
(1)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中含有苯酚,实验操作是 .从废水中回收苯酚的方法是:①取有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚从有机溶剂中脱离;③通入某物质又析出苯酚.试写出②、③步的化学方程式 、 ; .
(2)某醛的结构简式为检验分子中醛基的所用的试剂是 2 ,化学方程式为
或 ;
然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是 ;
(3)做过银镜反应的试管内壁的一层银,可用 除去.(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如下图进行的实验的说法,正确的是( )
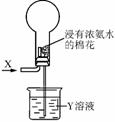
A.若X为HCl,则烧瓶内可产生白雾
B.选择适当的X和Y溶液可产生有色喷泉
C.若烧瓶内产生喷泉,则Y溶液一定呈酸性
D.若通入气体为Cl2,则烧瓶内一定无喷泉产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸 ②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性 ④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深 ⑥有单质生成的非氧化还原反应
A.全部 B.只有①③⑤ C.只有②④⑥ D.只有①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
.某工厂用硫酸处理氨气尾气,得到铵盐(不同批次得到a、b、c三种不同的铵盐)。称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,得到如下生成氨气的量与加入铵盐的量关系图:
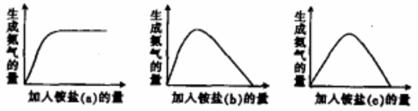
下列判断不正确的是:
A. a对应的铵盐是(NH4)2SO4
B. b对应的铵盐是(NH4)2SO4和NH4HSO4
C. c对应的铵盐是NH4HSO4
D. 当b和c铵盐的质量相同时,可得到相同量的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,有下列分子数相同的可逆反应,其平衡常数K值分别是
①H2+F22HF K=1047
②H2+Cl22HCl K=1017
③H2+Br22HBr K=109
④H2+I22HI K=1
比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是( )
A.①②③④ B.④②③①
C.①④③② D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com