
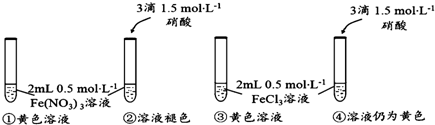

分析 (1)根据信息:①硝酸铁中存在:[Fe(H2O)6]3++H2O?[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+来判断;
(2)氯化铁中存在的[FeCl4(H2O)2]-为黄色;
(3)溶液的透光率和溶液中有颜色的离子的浓度大小之间有关系,根据温度对化学平衡移动的影响知识来回答;
(4)FeCl3溶液中存在:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,据平衡移动原理来回答;
(5)平衡[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O中,增加氯离子浓度,可以引起化学平衡的移动,据此回答.
解答 解:(1)根据信息:①硝酸铁中存在:[Fe(H2O)6]3++H2O?[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+,Fe(NO3)3溶液呈黄色的原因是[Fe(H2O)6]3+水解产生了黄色的[Fe(H2O)6-n(OH)n]3-n,
故答案为:[Fe(H2O)6]3+水解产生了[Fe(H2O)6-n(OH)n]3-n;
(2)FeCl3溶液呈黄色主要是发生:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,由于含有[FeCl4(H2O)2]-的缘故,因为:试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色,
故答案为:[FeCl4(H2O)2]-;试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色;
(3)溶液的透光率和溶液中有颜色的离子的浓度大小之间有关系,温度升高,导致平衡[Fe(H2O)6]3++nH2O?[Fe(H2O)6-n(OH)n]3-n+nH3O+正向移动,[Fe(H2O)6-n(OH)n]3-n浓度增大,溶液颜色加深;
故答案为:温度升高,导致平衡[Fe(H2O)6]3++nH2O?[Fe(H2O)6-n(OH)n]3-n+nH3O+正向移动,[Fe(H2O)6-n(OH)n]3-n浓度增大,溶液颜色加深;
(4)FeCl3溶液中存在:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,温度升高,有色离子浓度增加程度大,说明该反应是吸热反应,FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,故答案为:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O;吸热;
(5)平衡[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O中,增加氯离子浓度,可以引起化学平衡正向移动,有色离子浓度增加,进而说明FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,但是不能阴极铁离子,其铁离子的黄色会干扰实验结果,故答案为:B.
点评 本题是一道关于化学平衡移动原理的应用知识的实验方案设计探究题,考查学生分析和解决问题的能力,难度大.


科目:高中化学 来源: 题型:解答题
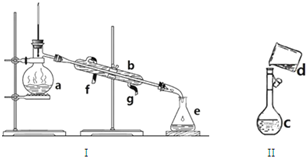
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-→ClO-+Cl-+H2O | |
| B. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-→Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:H++ClO-→HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池工作时,化学能转化为电能 | |
| B. | 手机电池在充电时,是电能转变为化学能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 人体运动所消耗的能量与化学反应无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者等物质的量完全燃烧消耗等量的氧气 | |
| B. | 二者分子所有原子都处于同一个平面上 | |
| C. | 二者能相互转化且反应属于可逆反应 | |
| D. | 二者可用酸性高锰酸钾溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
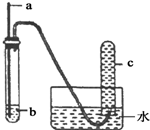 用下图所示装置进行实验,实验现象对应的结论正确的是( )
用下图所示装置进行实验,实验现象对应的结论正确的是( )| a | b | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | c中收集到大量无色气体 | 稀硝酸与铜反应生成NO2 |
| B | 木条 | 18.4mol/L浓硫酸 | 木条变黑 | 浓硫酸具有酸性 |
| C | 铁钉 | 饱和食盐水 | 部分水进入导管 | 铁钉发生吸氧腐蚀 |
| D | 铝片 | 浓硝酸 | 无明显现象 | 铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
带玻璃塞的试剂瓶 | 聚乙烯盒 | 铁罐车 | 铝制饭盒 |
| 可用于盛放氢氧化钠溶液 | 可用于盛装食品 | 可用于运输浓硫酸 | 不宜长时间存放酸性或碱性的食物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO${\;}_{2}^{-}$,则与过量NH3•H2O也生成AlO${\;}_{2}^{-}$ | |
| B. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com