
【题目】研究反应2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。
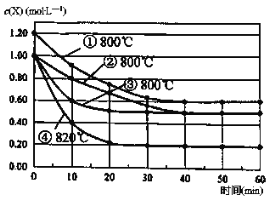
下列说法不正确的是
A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在0~10min之间,实验②的平均速率v(Y)=0.04molL-1min-1
【答案】D
【解析】A. X的起始浓度相等,温度升高,化学反应速率加快;B. 实验温度相同,随着反应物X的浓度增大,化学反应速率加快;C.其它条件下不变,催化剂能够加快反应速率;D.根据方程式中物质化学系数关系,根据v(Y)=C/t进行计算。
实验②、④两组实验,X的起始浓度相等,温度由第②组实验的800℃升高到820℃,反应速率明显加快,说明温度升高,化学反应速率加快,A正确。从图像可以看出,实验①、②两组实验温度相同,随着反应物X的浓度增大,化学反应速率加快,B正确;实验②、③,X的起始浓度相等,温度相同,平衡状态也相同,但是实验③反应速率快,到达平衡的时间短,说明实验③使用了催化剂,C正确;从图像可以直接求得0~10min之间实验②的平均速率:(1-0.8)/10=0.02 molL-1min-1,则根据化学方程式的计量数关系可知:v(Y)=0.01 molL-1min-1,D错误;正确选项D。


科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是
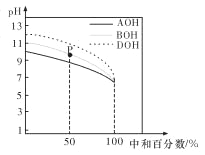
A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种关于酸的使用,其中正确的是
A. 为了抑制Fe2+的水解,用稀硝酸酸化 B. 检验溶液中是否含有SO42—时,先用盐酸酸化
C. 检验氯乙烷中的氯元素,水解后再用硫酸酸化 D. 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Na2O2中阴阳离子的的个数比为1∶1
B. 元素周期表中,包含元素种数最多的族是第ⅢB族
C. NaCl和HCl气化时,克服作用力完全相同
D. 金属化合物一定是离子化合物,不含金属元素的化合物有可能是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
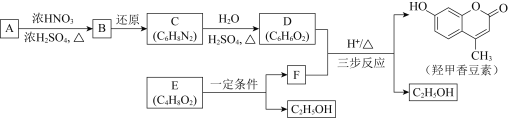
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
已知: 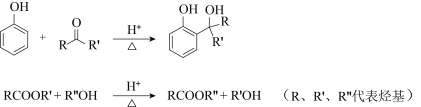
(1)A属于芳香烃,其结构简式是______。B中所含的官能团是______。
(2)C→D的反应类型是______。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______。
(4)已知:![]() 。F所含官能团有
。F所含官能团有![]() 和______。
和______。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
__________________,__________________,__________________,__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用术语来描述,下列有关化学用语的使用正确的是( )
A. NH4Cl的电子式:![]() B. S2–的结构示意图:
B. S2–的结构示意图:
C. CO2的结构式:O=C=OD. 中子数为20的氯原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种食品中常见的有机物,在实验室中,气体B能使溴水褪色生成C,物质F的分子式为C4H8O2,是一种有浓郁香味,不易溶于水的油状液体,请根据以下信息回答
相关问题:
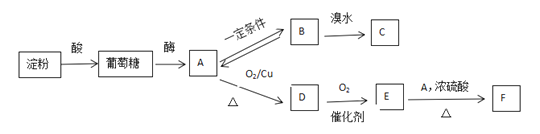
请回答:
(1)物质E中的官能团名称为:____________。
(2)物质B与溴水反应生成C的反应类型为:
____________________________________________________________________。
B与E在一定条件下反应生成F的化学方程式为:
____________________________________________________________________。
(4)X是有机物E的同系物,其相对分子质量是74,且化学性质与E相似。下列说法正确的是(_____)
A.有机物E能发生银镜反应 B.有机物A与X反应生成丙酸甲酯
C.甲酸甲酯是X的同分异构体 D.有机物A、D、E均能溶解于水
查看答案和解析>>
科目:高中化学 来源: 题型:
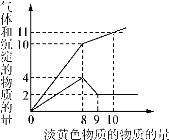
【题目】Ⅰ某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如下图所示。该淡黄色物质做焰色反应实验显黄色。可知溶液中含有的离子是________________;所含离子的物质的量浓度之比为____________;所加的淡黄色固体是______________。
Ⅱ.实验室采用滴定法测定某水样中亚硫酸盐含量:

(1)滴定时,KIO3和KI作用析出I2,完成并配平下列离子方程式:__IO3-+____I-+____===____I2+____H2O。
(2)反应(1)所得I2的作用是_________________________。
(3)滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:请回答下列问题:
![]()
(1)写出Al和NaOH溶液反应的离子方程式_______________________________。
(2)在点燃H2之前必须先进行____________________________________________。
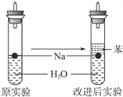
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是___________________________。
(4)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率____________。(填“减慢”或“加快”)
(5)将4.6gNa和8.1gAl投入到足量的水中,所得溶液的体积为200mL,则生成标准状况下的H2的体积是___________?该溶液中溶质的物质的量浓度是__________________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com