
����Ŀ��100��ʱ����0.1 mol N2O4����1L�ܱյ���ƿ����Ȼ����ƿ����100�� �ĺ��²�������ƿ��������Ϊ����ɫ��N2O4(g)![]() 2NO2 (g)�����н�������˵���������ڸ��������Ѿ��ﵽƽ��״̬��������
2NO2 (g)�����н�������˵���������ڸ��������Ѿ��ﵽƽ��״̬��������
��N2O4������������NO2����������֮��Ϊ1:2 ��NO2����������NO2�����������
����ƿ�������ѹǿ���ٱ仯 ����ƿ��������������ٱ仯
��NO2�����ʵ���Ũ�Ȳ��ٸı� ����ƿ���������ɫ���ٱ仯
����ƿ�������ƽ����Է����������ٱ仯 ����ƿ��������ܶȲ��ٱ仯��
A. �٢ۢ� B. �٢ܢ� C. �٢ڢ� D. �ܢޢ�
���𰸡�B
�������������۷�Ӧ�Ƿ�ﵽƽ��״̬��N2O4������������NO2����������֮�ȶ�Ϊ1��2�����Բ���֤���Ƿ�ﵽƽ��״̬����������NO2�����淴Ӧ������ȣ�������֤���ﵽƽ��״̬��������ȷ���۸÷�Ӧ�Ƿ�Ӧǰ����������ı�ķ�Ӧ�����÷�Ӧ�ﵽƽ��״̬ʱ�������ʵ����ʵ������ٸı䣬����ѹǿ�Ͳ��ٸı䣬��֤���÷�Ӧ�ﵽƽ��״̬��������ȷ���ܸ��������غ㣬���۸÷�Ӧ�Ƿ�ﵽƽ��״̬�������������������ٸı䣬���Բ���֤���÷�Ӧ�Ƿ�ﵽƽ��״̬����������ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯��������֤���÷�Ӧ�ﵽƽ��״̬��������ȷ����ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯����ƿ���������ɫ���ټ���˵��NO2Ũ�Ȳ��䣬������֤���÷�Ӧ�ﵽƽ��״̬��������ȷ���߸��ݷ�Ӧ����ʽ��֪�������ʵ����DZ��������������غ㶨�ɣ���ƿ����������ʼ�ղ��䣬����![]() ��ƽ����Է��������DZ��������Ե���ƿ�������ƽ����Է����������ٱ仯ʱ����֤���÷�Ӧ�ﵽƽ��״̬��������ȷ������������غ㣬��Ӧǰ�������������䣬������������䣬������ƿ��������ܶ�ʼ�ղ��䣬�������������Բ���˵���������ڸ��������Ѿ��ﵽƽ��״̬�����Ǣ٢ܢ���ѡB��
��ƽ����Է��������DZ��������Ե���ƿ�������ƽ����Է����������ٱ仯ʱ����֤���÷�Ӧ�ﵽƽ��״̬��������ȷ������������غ㣬��Ӧǰ�������������䣬������������䣬������ƿ��������ܶ�ʼ�ղ��䣬�������������Բ���˵���������ڸ��������Ѿ��ﵽƽ��״̬�����Ǣ٢ܢ���ѡB��


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Na2CO3��NaHCO3������������ǣ� ��
A.Na2CO3���������ת��ΪNaHCO3
B.��ˮ�е��ܽ��Na2CO3��NaHCO3��
C.NaHCO3����Ca��OH��2��Һ��Ӧ����Na2CO3����
D.��ͬŨ�ȵ����ᷴӦʱ��NaHCO3��Na2CO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�Ƕ�����Ԫ�أ��䲿���������±���
Ԫ�� | �� �� �� �� |
W | �����ǵ���ɫ���� |
X | �ڵؿ��еĺ����ӵڶ�λ |
Y | ԭ�������������Ǻ������������ |
Z | ��������ԭ�Ӱ뾶��С�Ľ��� |
����˵������ȷ���ǣ� ��
A.��һ�����ܣ�Y��Z
B.���Ӱ뾶��W��Z
C.X��Y�γɵĻ�����XY4�����ӻ�����
D.��ҵ�����õ������Z������������Z��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��CuFeS2�������ֺ���ͭ����Ҫԭ�ϣ��ڸ�������������������������������ͭ��������������������ͭ���Ǻ�ɫ��ĩ�����������ϣ�ijѧУ��ѧ��ȤС��ͨ��ʵ����̽������ɫ��ĩ��Fe2O3��Cu2O�����ߵĻ���̽���������£�[��������]Cu2O����ϡ��������Cu��CuSO4 �� �ڿ����м�������CuO��
[�������]����1����ɫ��ĩ��Fe2O3 ��
����2����ɫ��ĩ��Cu2O��
����3����ɫ��ĩ��Fe2O3��Cu2O�Ļ���
[���̽��ʵ��]ȡ������ĩ��������ϡ�����У���������Һ���ٵμ�KSCN�Լ���
��1��������1��������ʵ�������� ��
��2���μ�KSCN�Լ�����Һ�����ɫ��ijͬѧ��Ϊԭ�����ĩ��һ����������������������Ϊ����˵�������� �� ����������ɣ�����Ҫд����Ӧ�Ļ�ѧ����ʽ�� ��
��3���������ĩ��ȫ��Һ������ڣ��μ�KSCN�Լ�ʱ��Һ�����ɫ����֤��ԭ�����ĩ�� �� д��������������ԭ��Ӧ�����ӷ���ʽ�� ��
��4��[̽������]�����������ȷ����ɫ��ĩΪFe2O3��Cu2O�Ļ���ʵ��С���ȡ3.04g�ú�ɫ��ĩ���������ʵ�鷽������ʵ�飮�������ϵ�֪������Һ��ͨ��������Һ������Զ�ʹCu2+��Fe2+��Fe3+�ֱ����ɳ�����pH���£�
���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
��ʼ����ʱ��pH | 6.0 | 7.5 | 1.4 |
������ȫʱ��pH | 13 | 14 | 3.7 |
�����3.04g��ɫ��ĩ��������ϡ�����У��ټ�������H2O2��Һ�����ó�������ҺX��
���������ҺX�м�������Cu��OH��2��ĩ��������ҺpH=4.0�����ˣ��ú��ɫ����Y����ҺZ��
���������Y������գ���1.6g��ɫ����M��
�����������ҺZ����Ũ������ȴ�ᾧ�����ˣ���6.0gCuSO45H2O���壮
�ٳ���Y�Ļ�ѧʽΪ ��
�ڲ�����в���Ҫ�õ���ʵ������ ��
a���ձ�b��������c����Һ©��d���ƾ���e������̨������Ȧ��f��������ƽg����Ͳh��������i������ƿ��
�ۺ�ɫ��ĩ��Ʒ��Cu2O����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3.42 g������3.24 g���ۻ�ϲ���ȫˮ�⣬��������m g�����Ǻ�n g���ǣ���m��nΪ( )
A.1��3
B.1��5
C.5��1
D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�0.1molL��1��HA��Һ�� ![]() =1��10��8 �� ������������ȷ���ǣ� ��
=1��10��8 �� ������������ȷ���ǣ� ��
A.0.01 molL��1HA����Һ�� c��H+��=l��l0��4molL��1
B.pH=3��HA��Һ��pH=ll��NaOH��Һ�������Ϻ�������Һ�У�c��Na+��=c��A������c��OH����=c��H+��
C.Ũ�Ⱦ�Ϊ0.1 molL��1��HA��Һ��NaA��Һ�������Ϻ�������Һ�����ԣ���c��H+����c��OH������c��A������c��HA��
D.pH=3��HA��Һ��pH=11��NaOH��Һ��Ϻ�������Һ�Լ��ԣ��� c��Na+����c��A������c��OH��������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������в����ɻ��Ϸ�Ӧֱ�ӵõ�����
A. Fe��NO3��2 B. Fe��OH��3
C. FeCl3 D. Al��OH��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ���������������ת������������������ӦΪ��CH4(g)+H2O(g)![]() CO(g)+3H2(g)����֪�¶ȡ�ѹǿ��ˮ̼��[n(H2O)/ n(CH4)]�Լ���ƽ�⺬����%����Ӱ������ͼ1��
CO(g)+3H2(g)����֪�¶ȡ�ѹǿ��ˮ̼��[n(H2O)/ n(CH4)]�Լ���ƽ�⺬����%����Ӱ������ͼ1��

ͼ1��ˮ̼��Ϊ3�� ͼ2��800�棩
��1��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ����H_______0������>������<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫_____________�ƶ�����������Ӧ�������������淴Ӧ������������������
CO(g)+3H2(g) ����H_______0������>������<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫_____________�ƶ�����������Ӧ�������������淴Ӧ������������������
��2���¶ȶԸ÷�Ӧ�ķ�Ӧ���ʺ�ƽ���ƶ���Ӱ����_______________________��
��3�������������䣬����ͼ2������ѹǿΪ2 MPaʱ������ƽ�⺬����%����ˮ̼��֮���ϵ����___________����ֻҪ�����µı仯���ߣ�
��4����֪����700�棬1MPaʱ��1mol CH4��1mol H2O��2L���ܱ������з�Ӧ��6���Ӵﵽƽ�⣬��ʱCH4��ת����Ϊ80%������6����H2��ƽ����Ӧ���ʺ��¶��·�Ӧ��ƽ�ⳣ���Ƕ���________����д��������̣��������С�����һλ���֡���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ ![]() �ɼ�дΪ
�ɼ�дΪ ![]() ������Ƭϩ�ķ��ӽṹ�ɱ�ʾΪ��
������Ƭϩ�ķ��ӽṹ�ɱ�ʾΪ�� 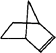
��1������Ƭϩ���� �� A ���� B �������� C ���� D ������
��2������Ƭϩ�ķ���ʽΪ ��
��3������Ƭϩ��һ��ͬ���칹�壨����һ����Ԫ���ĵ���������Ľṹ��ʽΪ ��
��4������Ƭϩ�����е����� �� A ������ˮ B �ܷ���������Ӧ
C �ܷ����ӳɷ�Ӧ D ���³�ѹ��Ϊ���壮
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com