


科目:高中化学 来源: 题型:








查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
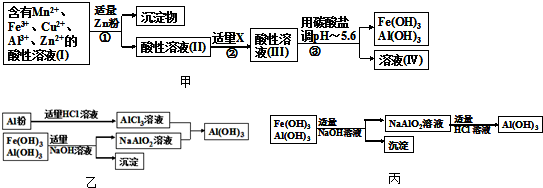
| 3n |
| 4 |
| 3n |
| 4 |
| 3n |
| 4 |
| 3n |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解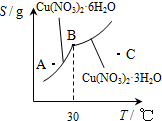
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
利用光能和光催化剂,可将CO2和H2O转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下左图所示。
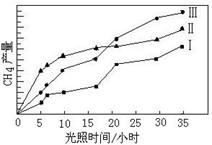
(1)在0-30小时内,CH4的平均生成速率vI、vII和vIII从大到小的顺序为 ;反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,一定温度下发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) K=27mol2·L-2。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,在上述温度下发生反应达到平衡,测得CO的物质的量为0.10mol,CH4的平衡转化率为 (保留两位有效数字)。
CO(g)+3H2(g) K=27mol2·L-2。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,在上述温度下发生反应达到平衡,测得CO的物质的量为0.10mol,CH4的平衡转化率为 (保留两位有效数字)。
(3)甲烷燃料电池是利用CH4跟氧气或空气反应将化学能转化成电能的装置,电解质溶液是强碱。下面有关说法正确的是 (填编号)。
A.负极反应为:O2+2H2O+4e- -→4OH-;
B.负极反应为:CH4+10OH- - 8e--→CO32-+7H2O
C.放电时溶液中的阴离子向负极移动
D.随放电的进行,溶液的pH值不变
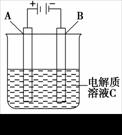
(4)如上右图是一个电化学装置示意图,甲烷燃料电池作其电源。
①如果A为含有铁、银、金、碳杂质的粗铜,B为纯铜,C为CuSO4溶液,通电后,Cu2+的浓度将 (填“增大”、“减小”或“不变”)。
②如果A是铂电极,B是石墨电极,C是KBr溶液,通电时阳极的电极反应式是__________________________。
③特定条件下,该装置使用惰性电极电解Na2SO4浓溶液可制得少量过氧化氢:在阳极上SO![]() 被氧化成S2O
被氧化成S2O![]() (过二硫酸根离子),S2O
(过二硫酸根离子),S2O![]() 与H2O反应即可生成H2O2,
与H2O反应即可生成H2O2,
S2O![]() +2H2O === 2SO
+2H2O === 2SO![]() +H2O2+2H+。若各反应物质的转化率均为100%,则要制取1 mol H2O2,理论上燃料电池需消耗CH4的物质的量为 。
+H2O2+2H+。若各反应物质的转化率均为100%,则要制取1 mol H2O2,理论上燃料电池需消耗CH4的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A、B、C、D、E均为钠盐,D、E具有相同的元素组成,都是由四种元素组成的化合物。向B溶液中滴加硝酸酸化的硝酸银溶液,立即产生白色沉淀,该沉淀见光变暗至灰至黑。A、B或B、C溶液混合均无明显现象,若将A、B、E和B、C、E分别按1:5:6和1:1:2的物质的量之比混合,溶液都能产生有刺激性气味黄绿色气体甲。D、E溶液混合能产生具有漂白性的刺激性气体乙。甲与乙混合气体通入水中会产生两种酸。B与E固体混合不反应,加热则能产生有刺激性气味的气体丙。若将气体丙通入A或C溶液中均能产生气体甲。甲气体通入D溶液,颜色会消失。若将A、D、E按2:1:1物质的量之比混合,能产生黄色气体丁。
请回答下列有关问题:
⑴.完成下列反应的离子方程式并配平之。
①.A + B + E → : ▲
②.D + E → : ▲
③.甲+乙+ H2O → : ▲
④.A + D + E → : ▲
⑵.丁气体消毒漂白性比甲强,是更理想的漂白试剂。相同条件下,相同体积的丁气体处理水的能力是甲的 ▲ 倍;相同质量的丁气体处理水的能力是甲的 ▲ 倍。
⑶.历史上曾把某元素的最高价的含氧酸称为某酸,如N、P、S等。A盐中对应的酸并不是该元素的最高价的含氧酸(当时误认为是最高价)。电解技术进入化学研究领域后,通过惰性材料电解A的水溶液,产生新的含氧酸盐(M=122.5 g·mol-1),我们可以把与其对应的酸称为高某酸。取出100 mL A盐溶液进行电解(惰性电极,通直流电),数小时后,收集到的阴、阳两极气体分别为6.72L和2.24L(已经折算成标准状况下的气体体积) 。
①.阴、阳两极所发生的电极反应离子方程式为 ▲ 、 ▲ 。
②.原A盐溶液的物质的量浓度为 ▲ 。(假设溶液体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com