
����Ŀ��ʵ������������������Ʊ��������������й����ʵ�����������±���
������ | ��Է������� | �ܶ� /g��cm-3 | �е� /�� | �ܽ�� /100gˮ |
������ | 74 | 0.80 | 118.0 | 9 |
������ | 60 | 1.045 | 118.1 | ���� |
���������� | 116 | 0.882 | 126.1 | 0.7 |

�������£�
����50mL������ƿ�У�����18.5mL��������13.4mL�����ᣬ3-4��Ũ���ᣬͶ���ʯ����װ��ˮ��![]() ���ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ
���ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ![]() ���¶ȼƼ����������ܡ�
���¶ȼƼ����������ܡ�
�ڽ���ˮ���ֳ�������ͷ�ӦҺһ�����Һ©���У�ˮϴ��10%Na2CO3��Һϴ�ӣ���ˮϴ�����ת������ƿ�����
�۽�����������������������ƿ�У���ѹ�����ռ���֣��õ�15.1g������������
��ش��й����⣺
��1����ˮӦ�ô�������___(����a������b��)�˹ܿ�ͨ�룻
��2����Ӧ��Ũ�����������___��
��3�����������10%Na2CO3��Һϴ���л��㣬�ò�����Ŀ����___��
��4�����з�Һ����ʱ��ʹ�õ�©����___(��ѡ��)��

��5��������ڽ����������ʱ������118�濪ʼ�ռ���֣�����ƫ__������������������)��ԭ��__��
��6����ʵ������У����������������IJ�����___��
���𰸡�a ��������ˮ�� ��ȥ��Ʒ�к��е���������ʣ������������������ܽ�ȱ��ڷ�Һ C �� ���ռ�������δ��Ӧ�ı������������ 65%
��������
(1)��ˮӦ�ô������ܵ��¿ڽ��Ͽڳ�����a�˽����ʴ�Ϊ��a��
(2)������Ӧ�У�Ũ���������������������ˮ�����ʴ�Ϊ����������ˮ����
(3)Na2CO3��Һϴ���л���������dz�ȥ��Ʒ�к��е���������ʣ������������������ܽ�ȱ��ڷ�Һ���ʴ�Ϊ����ȥ��Ʒ�к��е���������ʣ������������������ܽ�ȱ��ڷ�Һ��
(4)��Һ�����η�Һ©������C���ʴ�Ϊ��C��
(5)�������ķе�Ϊ118�棬������ķе�Ϊ118.1�棬����118�濪ʼ�ռ�������ռ����϶���������ʹ��ᣬ���²���ƫ�ߣ��ʴ�Ϊ���ߣ����ռ�������δ��Ӧ�ı��������������
(6)������������=0.8g��cm-3��18.5mL=14.8g��n(������)=![]() ��0.2mol�������������=1.045 g��cm-3��13.4mL=14.003g��n(������)=
��0.2mol�������������=1.045 g��cm-3��13.4mL=14.003g��n(������)=![]() ��0.23mol���������������������������������ֵ������CH3COOH+CH3CH2CH2CH2OH
��0.23mol���������������������������������ֵ������CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O��֪�������Ͽɵ�����������0.2mol�������Ͽɵ�����������������Ϊ��0.2mol��116g/mol=23.2g�����ԣ������������IJ���=
CH3COOCH2CH2CH2CH3+H2O��֪�������Ͽɵ�����������0.2mol�������Ͽɵ�����������������Ϊ��0.2mol��116g/mol=23.2g�����ԣ������������IJ���=![]() ��100%=65%���ʴ�Ϊ��65%��
��100%=65%���ʴ�Ϊ��65%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ni2O3��Ҫ�����մɡ��´ɺͲ�������ɫ����Ҳ���������۵����졣�����۷���Ϊԭ���Ʊ�Ni2O3�Ĺ������£�
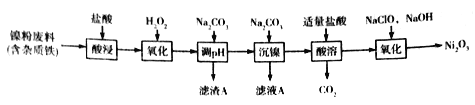
�ش��������⣺
��1��Ni2O3��Ni�Ļ��ϼ�Ϊ_________��
��2����ߡ�������������ܡ�����ʱ���¶Ȳ��˹��ߣ���ԭ����__________��
��3������H2O2�������������ӷ���ʽΪ_____________������A����Ҫ�ɷ���________���ѧʽ����
��4�������зֲ�����Na2CO3��������________��Ϊ���ԭ�ϵ������ʣ�Ӧ���Ƽ���NaClO��NaOH�����ʵ���֮��Ϊ_________��
��5����ҵ�ϣ�����Ϊ���������0.1mol/L NiCl2��Һ��һ����NH4Cl��ɵĻ����Һ���ɵøߴ��ȵ����γ�ϸ���ۡ�����������һ��ʱ��NH4Cl��Ũ�ȶ���������Ч�ʣ�����Ч����ָ���ʱ���ڵ缫��ʵ�ʳ��������ʵ���������������֮�ȣ������ijɷ��ʵ�Ӱ����ͼ��ʾ��
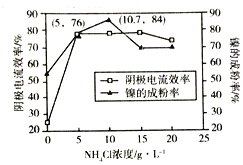
��Ϊ��øߴ��ȵ����γ�ϸ���ۣ�NH4Cl��Һ��Ũ����ÿ���Ϊ______mol/L.
�ڵ�NH4Cl��Һ��Ũ�ȴ���15g/Lʱ���������������ɣ�������������Ч�ʽ��ͣ�����ƽ���ƶ�ԭ��������ԭ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������������Դ�������ֲ��ϵ�����ʾ��ͼ���¡�����˵������ȷ����(����)

A. ���������Ʊ��ϸߴ���Al�Ĺ����г��õ�NaOH��Һ��CO2���塢����ʯ
B. ʯ��ʯ�����ʯӢ�������������Σ����������ᷴӦ
C. ���ƴֹ�ʱ���������������뱻��ԭ�����ʵ����ʵ���֮��Ϊ2��1
D. ��ͭ��(CuFeS2)��O2��Ӧ������Cu2S��FeO���ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
(1)�ǻ��ĵ���ʽ________________��
(2)��ʯ���ķ���ʽ___________��
(3)˳ʽ-2-��ϩ�Ľṹ��ʽ__________________��
(4)![]() ��ϵͳ����___________________________��
��ϵͳ����___________________________��
(5)д���ɼױ���TNT�ķ���ʽ_________________________________________
(6)2������1��3������ϩ������ʵ�����Br2�����ӳɷ�Ӧ�����������________��
(7)ij����ͬϵ�����Է���������92���ڹ����£�Cl2���Ժ��䷢��ȡ����Ӧ��ȡ���������Է���������126.5��д���÷�Ӧ����ʽ_________________________________
(8)���鼺ϩ���Ƿ���мױ����Լ���________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaFeO4��һ�ָ�Ч���ˮ���������Ʊ�����֮һ������
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2��������˵����ȷ����
A. ����������Na2FeO4
B. 1molFeSO4��ԭ3mol Na2O2
C. ת��0.5mo1����ʱ����16.6g Na2FeO4
D. ���������뻹ԭ��������ʵ���֮��Ϊ3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����������������й㷺Ӧ����
��1��Na3AlF6�DZ���ʯ����Ҫ�ɷ֣�����ʯ������ҵұ���������ۼ�����ҵ�ϣ���HF��Na2CO3��Al(OH)3�Ʊ�����ʯ����ѧ��Ӧԭ���ǣ�2Al(OH)3+3Na2CO3+12H=2Na3AlF6+3CO2��+9H2O.�����ε���Na2CO3��_______��������Ӧ�����ڲ��������з�Ӧ����ԭ����________(�û�ѧ����ʽ��ʾ)��
��2������[KAl(SO4)2��12H2O]������ˮ������������Һ�еμ�����������Һ��Al3+ǡ����ȫ������д���÷�Ӧ�����ӷ���ʽ____________��
��3�����Ͻ�㷺���ڽ������ϡ���������������������ɵ�ͬ�ֺϽ�ֱ����������ᡢ�����ռ���Һ��Ӧ����������������(ͬ��ͬѹ)����úϽ��������������֮��Ϊ______������֪:Si+2NaOH+H2O=Na2SiO3+ 2H2����
��4�����⻯��(NaAlH4)���л��ϳɵ���Ҫ��ԭ���������Ʊ������ǽ��⻯�ƺ��Ȼ����������з�Ӧ�Ʊ����⻯�ơ�
��д����ѧ����ʽ________________��
���ڻ�ѧ�ϣ����ԭ���Ļ�ԭ����������Ч������ʾ������Ч���������ǵ�λ�����ĺ��ԭ���Ļ�ԭ�����൱�ڶ��ٿ�������һ��غ��ԭ�����ⱻ������H2O������ԭ����������ʧȥ���������ٱ�ʾ��NaAlH4��NaH������Ч����֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ṩ��п����ͭƬ��500 mL 0.4 mol��L��1��H2SO4��Һ�����ߡ�1000 mL��Ͳ��������ͼװ�����ⶨп��ϡ���ᷴӦʱ��ij��ʱ����ͨ�����ߵĵ��ӵ����ʵ�����

��1����ͼ��ʾ��װ�����������ã���1 000 mL��Ͳ���ѳ�����ˮ����ʼʵ��ʱ������Ҫ______��
��2��a�缫����Ϊ________����缫��ӦʽΪ______________��b�缫����Ϊ________����缫��ӦʽΪ______________��
��3�� ����Ͳ���ռ�672 mL����ʱ(�����㵽��״����)��ͨ�����ߵĵ��ӵ����ʵ���Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���( )
A. ��H2����������HI��ɵ�ƽ����ϵ��ѹ����ɫ����
B. ����ɫ����ˮ���պ���ɫ��dz
C. ��ѹ��ʹ�����SO2ת��ΪSO3
D. �ں���Fe(SCN)2+�ĺ�ɫ��Һ�м����ۣ����ã���Һ��ɫ��dz����ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Co(H2PO2)2�㷺���ڻ�ѧ���ܣ��Խ���Co��NaH2PO2Ϊԭ�ϣ��������ҵ������۵�ⷨ�Ʊ���ԭ����ͼ������������ȷ����

A. bΪ�����ӽ���Ĥ
B. ͨ���ԭ���ҵ�H2PO2���Ʒ��Ǩ�ƣ���������ҺpH����
C. ʯī�缫��ӦΪ4OH4e![]() O2��+2H2O
O2��+2H2O
D. ������1 mol Co(H2PO2)2ʱ��������״��������11.2 L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com