

| A. | 电子由石墨电极流向银电极 | |
| B. | 多孔石墨电极上发生发生氧化反应 | |
| C. | 正极的电极反应式方程式为:2Ag++I2+2e -═2AgI | |
| D. | 当电池中有1 mol e一转移时消耗02的体积5.6 L |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
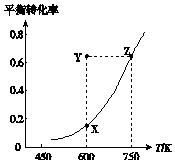 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )| A. | △H<0 | B. | 从Y点到Z点可通过升高温度实现 | ||
| C. | 从Y点到X点可通过使用催化剂实现 | D. | 600 K时,Y点甲醇的v正<v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
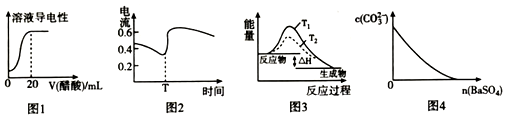
| A. | 图1表示向20mL0.lmol•L-l氯水中逐滴加入0.lmol•L-1醋酸,溶液导电性随加入酸体积的变化 | |
| B. | 图2表示酸性介质Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了 H2O2 | |
| C. | 图3表示S02与O2反应过程中的能量变化,其中T1>T2 | |
| D. | 图4表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c( CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除去杂质使用的试剂 | 除去杂质的方法 |
| A | CO2气体(HC1气) | 饱和Na2CO3溶液,浓硫酸 | 洗气 |
| B | NH4Cl固体(I2) | 加热 | |
| C | FeCl2溶液(FeCl3) | 氯水 | |
| D | MgCl2溶液(A1C13) | NaOH溶液,稀盐酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
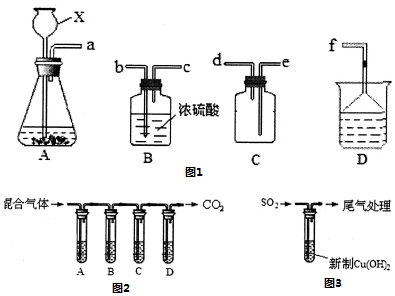
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N的正反应速率是M的逆反应速率的3倍 | |
| B. | 恒温恒容下,通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 恒温下,扩大容器体积至原来的两倍,则N物质的量浓度大于0.6 mol/L | |
| D. | 恒温恒压下,增加Z的物质的量,重新达平衡时,N物质的量浓度大于0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
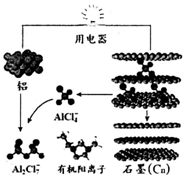 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,电子山石墨电极经用电器流向铝电极 | |
| B. | 充电时,铝电极上发生氧化反应 | |
| C. | 充电时,AlCI4-向铝电极方向移动 | |
| D. | 放电时,负极反应为:Al-3e-+7 AlCl4-═4A12C17- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 铁粉溶于浓盐酸:Fe+2H+=Fe2++H2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| D. | 小苏打溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com