
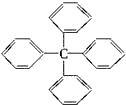
| A. | 此物质分子式为C25H18,属于苯的同系物 | |
| B. | 其一氯代物共有四种 | |
| C. | 此分子最多有13个碳原子在一个平面上 | |
| D. | 该物质能使溴水因化学反应而褪色 |
分析 由结构可知分子式,分子只含苯基为平面结构,中间的C为四面体构型,则只有2个苯环与中间的C共面,结构对称,只有3种H,以此来解答.
解答 解:A.含有4个苯环,与苯的同系物的结构不同,不是同系物,故A错误;
B.结构对称,苯环上只有3种H,此物质的一氯代物有3种,故B错误;
C.苯环为平面形结构,结合三点确定一个平面,当苯环沿碳轴旋转到一定角度时,最多有13个C原子共平面,故C正确;
D.与苯具有相似的性质,与溴水不反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于考查学生的分析能力和综合运用化学知识的能力,注意把握有机物的空间结构为解答该题的关键,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1mol水蒸气,转移电子4mol | |
| D. | 放电时正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、②、⑥分子中碳原子数小于10,③、④、⑤、⑦分子中碳原子数大于10 | |
| B. | ①、②是无机物,③、⑤、⑦是有机物 | |
| C. | ①、②是酸性化合物,③、⑤不是酸性化合物 | |
| D. | ②、③、④含氧元素,⑤、⑥、⑦不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
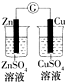 | 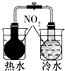 | 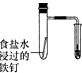 | 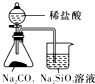 |
| 验证化学能转化为电能 | 验证温度对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证非金属Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
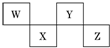
| A. | W、Y可形成两种不同的化合物 | |
| B. | Z的阴离子电子层结构与氩原子的相同 | |
| C. | W的简单氢化物的沸点比Y的氢化物的沸点高 | |
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5mol N2中含有0.5NA个N | |
| B. | 32gO2中含有的氧原子数为2NA | |
| C. | H2的摩尔质量是为2 | |
| D. | 1molH2SO4在水溶液电离出离子约为1.806×1024个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com