
| A�� | �ڶ�����Ԫ���⻯���ȶ���˳����HF��H2O��NH3�����������Ԫ���⻯���ȶ���˳��Ҳ��HCl��H2S��PH3 | |
| B�� | SiO2�����ۻ�ʱ�ƻ����ǹ��ۼ�������CO2�����ۻ�ʱ�ƻ���Ҳ�ǹ��ۼ� | |
| C�� | �ɵ������MgCl2����ȡ����þ��Ҳ�ܵ������AlCl3����ȡ������ | |
| D�� | �������������ӣ����������ӣ��������������ӣ�Ҳ���������� |
���� A���ǽ�����Խǿ�⻯��Խ�ȶ���
B��������̼���ڷ��Ӿ��壬������̼�����ۻ�ʱ�ƻ����Ƿ��Ӽ���������
C���Ȼ������ڹ��ۻ��������״̬�²��ܵ��磻
D���ڽ��������У����ڽ��������Ӻ������ƶ��ĵ��ӣ�
��� �⣺A��ͬ������ԭ����������Ԫ�طǽ�������ǿ���ǽ�����Խǿ�⻯��Խ�ȶ����ʵڶ������ȶ���HF��H2O��NH3�����������⻯���ȶ���HCl��H2S��PH3����A��ȷ��
B��������������ԭ�Ӿ��壬�ۻ�ʱ�ƻ����ۼ�����������̼����Ϊ���Ӿ��壬�ۻ�ʱ�ƻ����Ƿ��Ӽ�����������B����
C��MgCl2�����ӻ����������״̬�µ��磬���õ�����ڵ�MgCl2����ȡ����þ��AlCl3�ǹ��ۻ����������״̬�²����磬�ʲ����õ�����ڵ�AlCl3����ȡ����������C����
D���������������ӣ�δ��һ���������ӣ��磺�ڽ��������У����ڽ��������Ӻ������ƶ��ĵ��ӣ���D����
��ѡA��
���� ���⿼����̽����ѧ���ɣ���Ŀ�Ѷ��еȣ��漰�������ͼ���������Ԫ�صķǽ�����ǿ�����ж��Լ�������ұ��֪ʶ������֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ���ѧ���ķ������������Ӧ�û���֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
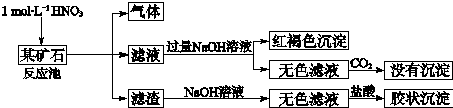
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol | B�� | 0.4mol | C�� | 0.6mol | D�� | 0.8mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6.8 g���ڵ�KHSO4�к���0.05NA�������� | |
| B�� | 1.0 L 2 mol/L��NaOH��aq���к��е���ԭ����ĿΪ2NA | |
| C�� | ��24 g18O2�к���1.5NA����ԭ�� | |
| D�� | �ڷ�ӦKIO3+6HI=KI+3I2+3H2O�У�ÿ����3 mol I2ת�Ƶĵ�����Ϊ6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.03mol/L HA��0.03mol/L NaA�������ϵõ��ļ�����Һ�У�c��Na+����c��A--�� | |
| B�� | ������Һ��ˮ�ĵ���̶�һ���ȴ�ˮ�ĵ���̶�С | |
| C�� | pH��ȵ�CH3COONa��NaOH��Na2CO3������Һc��NaOH����c��CH3COONa��c����Na2CO3 | |
| D�� | �����£�pH=3��CH3COOH��Һ��pH=11��NaOH��Һ�������Ϻ�pH����7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������� | B�� | �⻯�� | C�� | ������ | D�� | �Ȼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
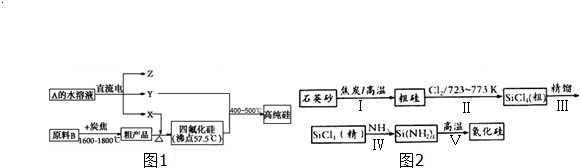
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com