
下列说法正确的是
A.标准状况下44.8L乙醇含有氢原子数为12NA
B.1mol气体的体积只有在标准状况下才是22.4L
C.常温常压下,等质量的N2和N4中所含氮原子数相同
D.标准状况下,1.12L CO和N2的混合气体含有约6.02×1022个分子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 中和10mL 1 mol•L-1 CH3COOH溶液需要10 mL 1 mol•L-1 NaOH溶液 | |
| B. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快 | |
| C. | 0.01mol•L-1醋酸溶液的pH大于2 | |
| D. | 0.1mol•L-1 CH3COONa溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
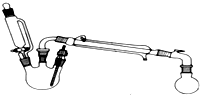 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2R是二元弱酸,其Kal=1×10-2 | |
| B. | 当溶液恰好呈中性时,c(Na+)=2c(R2-)+c(HR-) | |
| C. | NaHR在溶液中水解倾向大于电离倾向 | |
| D. | 含Na2R与NaHR各0.1mol的混合溶液的pH=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 2.0gH218O与D216O的混合物中所含中子数为NA | |
| C. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com