
【题目】在一定条件下,使一定量的A和B气体混合发生反应:2A(g)+3B(g)![]() C(g)。下列描述中,说明反应已经达到平衡状态的是( )
C(g)。下列描述中,说明反应已经达到平衡状态的是( )
A.各物质的浓度之比c(A):c(B):c(C)=2:3:4
B.混合气体中各物质的浓度相等
C.单位时间内,若消耗了2amolA,同时也消耗了amolC
D.混合气体的体积是反应开始前的![]()
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是![]()
A.蒸馏操作时,应使温度计水银球伸入蒸馏烧瓶液面下
B.铂丝蘸取试样灼烧,火焰呈黄色,则该试样一定是钠盐
C.测定溶液的pH的规范操作是:用干燥洁净的玻璃棒蘸取溶液,点在pH试纸中央,跟标准比色卡比较
D.分液时,分液漏斗下层液体先从下口放出,然后将上层液体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 乙酸乙酯与稀硫酸共热、搅拌 | 液体不再分层 | 乙酸乙酯在酸性条件下完全水解成可溶性物质 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 生成白色沉淀 | 蛋白质发生了变性 |
C | 淀粉在稀硫酸的作用下水解后,加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生可逆反应:2X(g)![]() Y(g)+Z(s),下列选项能说明该反应达到平衡状态的是( )
Y(g)+Z(s),下列选项能说明该反应达到平衡状态的是( )
A.X的分解速率与Y的分解速率相等
B.X、Y、Z的物质的量之比为2:1:1
C.混合气体的密度不再变化
D.单位时间内生成1molY的同时分解2molx
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示两种晶体的微观结构:
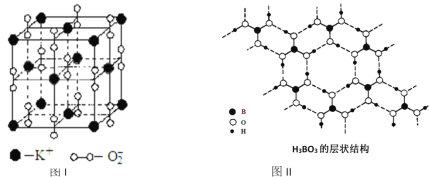
试回答下列有关问题:
(1)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有_________个,0价氧原子与-2价氧原子的数目比为_________;
(2)正硼酸(H3BO3)是一种片层结构的白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有_________。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中每个B与相邻的3个O共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
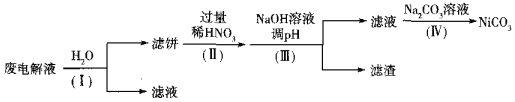
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com