

分析 (1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则反应的方程式为2S+3Cl2+SO3$\frac{\underline{\;一定条件\;}}{\;}$3SOCl2,根据方程式可知三者的物质的量比,SOCl2遇水剧烈反应生成SO2与HCl;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸;
②根据逆流冷却效果好进行判断;
③ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,结合氯离子守恒计算;
④ZnCl2加热时会水解为氢氧化锌与HCl,氯化氢挥发,氢氧化锌受热分解为ZnO;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,可以检验硫酸根、亚铁离子或铁离子判断.
解答 解:(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则反应的方程式为2S+3Cl2+SO3$\frac{\underline{\;一定条件\;}}{\;}$3SOCl2,所以三者的物质的量比为2:3:1,SOCl2遇水剧烈反应生成SO2与HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:2:3:1;SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→E→F→C,
故答案为:D;E;F;C;
②逆流冷却效果好,应从b口进水,
故答案为:b;
③ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒:$\frac{ag}{136g/mol}×2$=$\frac{bg}{143.5g/mol}$,解得$\frac{b}{a}$=2.1;
故答案为:2.1;
④ZnCl2加热时会水解为氢氧化锌与HCl,氯化氢挥发,氢氧化锌受热分解为ZnO,不能得到ZnCl2,该方案不可行,反应的方程式为ZnCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+ZnO+(x-1)H2O,
故答案为:ZnCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+ZnO+(x-1)H2O;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,可以检验硫酸根、亚铁离子或铁离子判断,检验铁离子,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应,
故答案为:没有明显现象;Fe2+、SO42-.
点评 本题考查物质制备实验、实验方案设计、对原理与操作的分析与评价、化学计算等,关键是对实验原理的理解,较好地考查学生实验能力、计算能力、知识迁移运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl溶液 | |
| B. | 用氢氧化钠鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用澄清石灰水鉴别SO2、CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时,v (A):v (B):v (C):v (D)=4:3:2:1 | |
| B. | 该反应体系中气体的平均相对分子质量不变不可作为平衡标志 | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | C的平均反应速率为:0.15mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将某溶液中加入盐酸,有气体生成,气体能使澄清石灰水变浑浊 | 该溶液中有CO32- |
| B | 向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失 | 该原溶液一定含有SO42- |
| C | 下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,再将上层液体从下端管口放出 | 取出分液漏斗中的上层液体 |
| D | 向某溶液中加入NaOH溶液并加热,有气体产生,用湿润的红色石蕊试纸,试纸显蓝色 | 说明该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
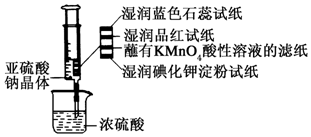 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸只变红不褪色 | |
| B. | 湿润的品红试纸蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2不能将I-还原为I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | H2O2+H2SO4=SO2↑+O2↑+2H2O | ||
| C. | SO2+I2+2H2O=H2SO4+2HI | D. | 2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 83% | B. | 17% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 污染物 | 速度/(km•h-1) | |||
| 50 | 80 | 90 | 120 | |
| 一氧化碳/g | 8.7 | 5.4 | 4.7 | 9.6 |
| 氮的氧化物/g | 0.6 | 1.5 | 1.7 | 3.8 |
| 碳氢化合物/g | 0.7 | 0.6 | 0.5 | 0.8 |
| A. | 50 | B. | 80 | C. | 90 | D. | 120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com