
分析 (1)室温下水的离子积为1×10-14;
(2)强酸溶液稀释,氢离子浓度随体积变化减小,氯化铵溶液稀释除随体积变化浓度减小外,稀释促进铵根离子的水解,氢离子浓度增大;
(3)氯化铵水解过程是吸热反应,加热溶液,促进水解氢离子浓度变大,硫酸溶液加热,氢离子浓度基本不变;
(4)硫酸中的氢氧根离子是水电离的,氯化铵溶液中的氢离子是水电离的,据此进行计算;
(5)氯化铵溶液稀释促进水解平衡正向进行,依据溶液中体积相同,离子浓度之比可以比较离子物质的量之比.
解答 解:(1)室温下两溶液中水的离子积Kw=c(H+)•c(OH-)=1×10-14,
故答案为:1×10-14;
(2)室温的条件下,pH均为a的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加水稀释至50mL,稀释10倍,硫酸溶液PH变化为a+1,氯化铵铵根离子水解促进,溶液中氢离子浓度减小的少,溶液PH小于a+1,pH较大的是硫酸溶液;
故答案为:H2SO4;
(3)室温的条件下,pH均为a的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加热到90℃,硫酸溶液中氢离子浓度变化不大,氯化铵溶液中水解是吸热反应,加热促进水解,氢离子浓度又增大,PH变化小于a+1,溶液pH较小的是氯化铵溶液,
故答案为:NH4Cl;
(4)室温的条件下,pH均为a的H2SO4溶液和NH4Cl溶液中存在离子积常数,硫酸溶液中,c(H+)酸×c(OH-)水=10-14,则水电离的氢氧根离子的浓度c(OH-)水=$\frac{1{0}^{-14}}{1{0}^{-a}}$=1×10a-14mol∕L;氯化铵溶液中,c(H+)水×c(OH-)水剩余=10-14,则水电离的氢离子浓度为c(H+)水=1×10-amol∕L,
故答案为:1×10a-14 mol•L-1;1×10-a mol•L-1;
(5)取5mL NH4Cl溶液,加水稀释至50mL,体积变化氢离子浓度减小10倍,稀释促进水解平衡,所以溶液中氢离子浓度小于10-a,大于10-(a+1);铵根离子水解平衡NH4++H2O?NH3•H2O+H+;稀释会得到促进,溶液中的铵根离子减小,氢离子增多,$\frac{c(N{{H}_{4}}^{+})}{c({H}^{+})}$离子浓度比值减小,
故答案为:>;减小.
点评 本题考查了盐类水解的应用判断、溶液pH的计算等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理及其影响因素.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 25.6g | B. | 24.4g | C. | 24.6g | D. | 262g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3熔点高,可用于制作耐高温仪器 | |
| B. | 高纯度的硅单质用于制作光导纤维,光导纤维有导电性 | |
| C. | H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性 | |
| D. | 明矾净水与胶体的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2反应速率3 mol•l-1•min-1 | B. | N2反应速率0.3 mol•l-1•s-1 | ||
| C. | H2反应速率0.3mol•l-1•s-1 | D. | NH3反应速率0.4mol•l-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
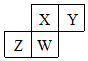 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 干法 | Fe2O3、KNO3、KOH 混合加热共熔生成紫红色 K2FeO4 和 KNO2 等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3和 KClO 反应生成紫红色 K2FeO4溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2中所含的中子数为42NA | |
| B. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| C. | 2mol•L-1的FeCl3溶液溶液中含有的Fe3+数目小于2NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30gNO和30gSiO2中含有的氧原子数均为NA | |
| B. | 0.5L2.0mol•L-1NaHSO3溶液中含有的HSO3-数目为NA | |
| C. | 标准状况下,5.6LN2与足量的H2反应生成NH3转移的电子数为1.5NA | |
| D. | 标准状况下,11.2LNH3与11.2LHCl混合后所得气体中分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性 | B. | 最高价氧化物对应的水化物的酸性 | ||
| C. | 单质与氢气反应的难易 | D. | F-和Cl-的还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com