
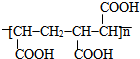 .
.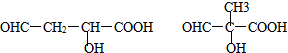
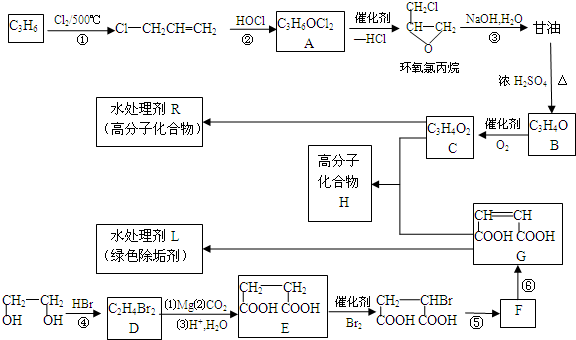
 的合成路线(无机原料任选).
的合成路线(无机原料任选).分析 在500℃条件下,丙烯和氯气发生取代反应生成3-氯丙烯,3-氯丙烯和HOCl发生加成反应生成A,A发生消去反应生成环氧氯丙烷,环氧氯丙烷和氢氧化钠的水溶液反应生成丙三醇,在浓硫酸作催化剂、加热条件下,丙三醇反应生成B,B能被氧化生成C,C比B中多一个氧原子,则B中含有醛基,C中含有羧基,B的不饱和度=$\frac{3×2+2-4}{2}$,所以B是丙烯醛,C是丙烯酸,C和G发生加成反应生成高分子化合物H,H的结构简式为: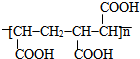 ;G发生加聚反应生成L,L的结构简式为:
;G发生加聚反应生成L,L的结构简式为: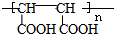 ,乙二醇和氢溴酸发生取代反应生成1,2-二溴乙烷,1,2-二溴乙烷反应生成1,4-丁二酸,1,4-丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G;C是丙烯酸,用C为原料合成
,乙二醇和氢溴酸发生取代反应生成1,2-二溴乙烷,1,2-二溴乙烷反应生成1,4-丁二酸,1,4-丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G;C是丙烯酸,用C为原料合成 ,可以先用丙烯酸与水加成生成2-羟基丙酸,再用2-羟基丙酸发生酯化可得
,可以先用丙烯酸与水加成生成2-羟基丙酸,再用2-羟基丙酸发生酯化可得 ,据此答题.
,据此答题.
解答 解:在500℃条件下,丙烯和氯气发生取代反应生成3-氯丙烯,3-氯丙烯和HOCl发生加成反应生成A,A发生消去反应生成环氧氯丙烷,环氧氯丙烷和氢氧化钠的水溶液反应生成丙三醇,在浓硫酸作催化剂、加热条件下,丙三醇反应生成B,B能被氧化生成C,C比B中多一个氧原子,则B中含有醛基,C中含有羧基,B的不饱和度=$\frac{3×2+2-4}{2}$,所以B是丙烯醛,C是丙烯酸,C和G发生加成反应生成高分子化合物H,H的结构简式为: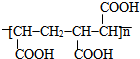 ;G发生加聚反应生成L,L的结构简式为:
;G发生加聚反应生成L,L的结构简式为: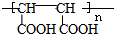 ,乙二醇和氢溴酸发生取代反应生成1,2-二溴乙烷,1,2-二溴乙烷反应生成1,4-丁二酸,1,4-丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G,
,乙二醇和氢溴酸发生取代反应生成1,2-二溴乙烷,1,2-二溴乙烷反应生成1,4-丁二酸,1,4-丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G,
(1)在500℃条件下,丙烯和氯气发生取代反应生成3-氯丙烯,3-氯丙烯和HOCl发生加成反应生成A,
故答案为:取代反应;加成反应;
(2)反应④通常用一种盐和一种酸代替HBr参加反应,这种酸和盐能生成溴化氢,氢溴酸是强酸,则所用酸为难挥发性的强酸,为浓硫酸,盐为溴化钠,
故答案为:溴化钠;浓硫酸;
(3)B是丙烯醛,丙烯醛和氢氧化铜悬浊液反应生成丙烯酸和氧化亚铜、水,反应方程式为:CH2=CH-CHO+2Cu(OH)2$\stackrel{△}{→}$CH2=CH-COOH+Cu2O↓+2H2O,
故答案为:CH2=CH-CHO+2Cu(OH)2$\stackrel{△}{→}$CH2=CH-COOH+Cu2O↓+2H2O;
(4)通过以上分析知,H的结构简式为: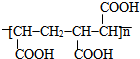 ,
,
故答案为: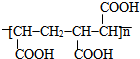 ;
;
(5)E是1,4-丁二酸,E有多种同分异构体,其中能发生银镜反应说明含有醛基,能发生缩聚反应说明含有醇羟基和羧基,且还能两分子生成六元环状化合物,则符合条件的E的同分异构体结构简式为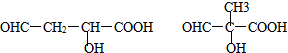 ,
,
故答案为: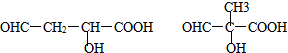 ;
;
(6)C是丙烯酸,用C为原料合成 ,可以先用丙烯酸与水加成生成2-羟基丙酸,再用2-羟基丙酸发生酯化可得
,可以先用丙烯酸与水加成生成2-羟基丙酸,再用2-羟基丙酸发生酯化可得 ,合成路线为
,合成路线为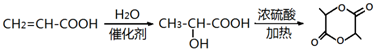 ,
,
故答案为: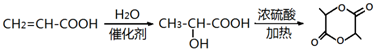 .
.
点评 本题考查了有机物的推断,明确有机物的官能团及其性质是解本题关键,注意反应物相同,如果反应条件不同,则产物不同,难点是同分异构体的判断,难度较大.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
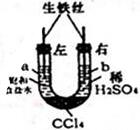 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a处、b处溶液的pH都增大 | |
| D. | a、b两处具有相同的电极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应可表示为2SO2+O2+2H2O$\stackrel{NO_{2}}{→}$2H2SO4 | |
| B. | 还可能发生的反应有4NO2+O2+2H2O→4HNO3 | |
| C. | NO2由反应N2+O2$\stackrel{放电}{→}$NO2生成 | |
| D. | 还可能发生的反应有4NO+3O2+2H2O→4HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Br-、SO42- | |
| B. | Al3+、Cl-、OH-、HCO3- | |
| C. | pH=0的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3COO-、SO42-、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物进行光合作用时,将太阳能转化为化学能“储存”起来 | |
| B. | 物质发生化学反应过程中一定伴随着能量变化 | |
| C. | 可将反应“NaOH+HCl═NaCl+H2O”的化学能通过原电池转化为电能 | |
| D. | 化学反应使放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 在共价化合物中一定含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com