
观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模 型示意 图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | B的熔点为1873K |
A.HCN的结构式为H—C≡N
B.固态S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属于原子晶体,其结构单元中含有30个B—B键
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学专题突破训练 专题13物质结构与性质选修3练习卷(解析版) 题型:填空题
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 。
(2)Y元素原子的电子排布图为 ,元素X与Y的电负性比较:X Y(填“>”或“<”)。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 。
(4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心)
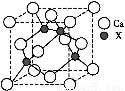
请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为 。
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 。
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:填空题
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。

(1)基态Ni2+的核外电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的电负性由大到小的顺序为 。丁二酮肟分子中C原子轨道的杂化类型是 。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质性质的应用错误的是
A.Al2O3的熔点很高,可用于制造耐火材料
B.H2O2有氧化性,可用于杀菌消毒
C.常温下,铝遇浓硫酸会钝化,可用铝槽车运输浓硫酸
D.Na2SO4浓溶液能使蛋白质溶液发生盐析,可用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习5-3微粒间相互作用力与物质多样性练习卷(解析版) 题型:选择题
下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是( )
ABCD


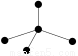

NH3C2H2CCl4CO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习10-1化学实验常用仪器和基本操作练习卷(解析版) 题型:选择题
化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是( )
①在制氧气时,排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②在气体发生装置上直接点燃一氧化碳气体时,必须先检验一氧化碳气体的纯度。最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声
③实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
④给试管中的液体加热时,不时移动试管,以免暴沸伤人
⑤不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼
⑥配制稀硫酸时,可先在烧杯中加入一定体积的水,再边搅拌边加入浓硫酸
A.①② B.②③ C.④⑤ D.②⑥
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-3 人工合成有机化合物练习卷(解析版) 题型:选择题
一次性使用的聚苯乙烯(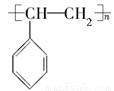 )材料易造成“白色污染”,其替代物聚乳酸(
)材料易造成“白色污染”,其替代物聚乳酸(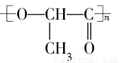 )是由乳酸(
)是由乳酸(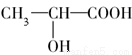 )聚合而成的,聚乳酸可在乳酸菌的作用下降解。下列说法正确的是( )
)聚合而成的,聚乳酸可在乳酸菌的作用下降解。下列说法正确的是( )
A.聚苯乙烯的单体为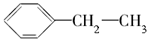
B.聚苯乙烯的聚乳酸的聚合方式相似
C.聚苯乙烯和聚乳酸均为纯净物
D.乳酸可发生消去反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是________(填字母序号)。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com