
(9分)下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
| a | | | |||||||||||||||
| | | | | f | | h | i | | |||||||||
| | b | | e | | | | j | | |||||||||
| c | | | | | | | | d | | | | | g | | | k | |
| | | | | | | | | | | | | | | | | l | |
(1)第四周期 第Ⅷ族 ;(2)1s22s22p63s23p63d104s24p5;(3)Cl>Al>Mg; Cl>Mg>Al;
(4)Al(OH)3+OH-=AlO2-+2H2O;(5)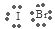 ; 极性;共价。
; 极性;共价。
解析试题分析:(1)根据元素在周期表中的位置可知:d在元素周期表中的位置是第四周期 第Ⅷ族;(2)元素k是Br元素,其核外电子排布式是1s22s22p63s23p63d104s24p5;(3)b、e、j三种元素是同一周期的元素,元素的原子序数越大,元素的电负性就越大,所以这三种元素的电负性由大到小的顺序是:Cl>Al>Mg;元素的电负性越大,电离能就越大,所以此三种元素的第一电离能由大到小的顺序是Cl>Mg>Al;(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水化物与a、c、h三种元素形成的化合物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。k、l的互化物的电子式是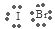 ;它是由极性键形成的共价化合物。
;它是由极性键形成的共价化合物。
考点:考查 元素的推断、原子核外电子排布式、电负性、电离能的比较、离子方程式的书写及物质的结构。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
原子结构模型的演变图中,①为道尔顿实心球式原子模型、②为卢瑟福带核的原子模型、③为汤姆生葡萄干面包式原子模型、④为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是( )
① ② ③ ④
| A.①③②④ | B.①②③④ |
| C.①④③② | D.①③④② |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
| A.47 | B.57 |
| C.61 | D.175 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试回答:
(1)写出A和C组成的化合物的电子式________________________________;
(2)B的离子结构示意图是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成一种盐,该盐的化学式是 ;
(3)写出C元素的单质和甲烷发生一元取代反应的化学方程式____________________ ;
(4)写出A最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题: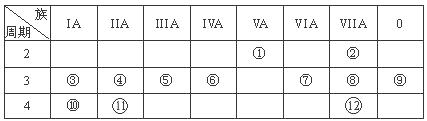
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~?元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | | | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑩ |
| 4 | | | | | | | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)氮元素可以形成多种化合物。
(1)基态氮原子的价电子轨道表示式是 。
(2)已知尿素的结构式为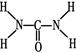 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是;
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
当肼燃烧放出519.35kJ热量时,形成的π键有mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点FeO NiO (填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为 。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的强相互作用是 ;
(3)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式: 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。
③下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com