
【题目】丁烷、甲烷、乙醛的混合气体在同温同压下和CO2的密度相同,则三种气体的体积比可能是( )
①2:1:4 ②5:2:1 ③2:5:1 ④6:3:2 ⑤4:2:3
A. ①②B. ②③C. ③④⑤D. ①④⑤
【答案】D
【解析】
根据在同温同压下密度相同,则物质的相对分子质量也相等,所以丁烷、甲烷、乙醛的平均摩尔质量为44g/mol,乙醛的摩尔质量为44g/mol,则甲烷和丁烷的平均摩尔质量一定为44g/mol,据此进行解答。
甲烷的化学式为:CH4,其相对分子质量为16;丁烷的化学式为:C4H10,其相对分子质量为58;乙醛的化学式为:C2H4O,其相对分子质量为44;二氧化碳的相对分子量为44,相同条件下气体的密度与摩尔质量成正比,则丁烷、甲烷、乙醛的平均摩尔质量为44g/mol,由于乙醛的摩尔质量为44g/mol,则乙醛含量不影响平均摩尔质量,关键是甲烷和丁烷的平均摩尔质量为44g/mol,设甲烷的物质的量为x、丁烷的物质的量为y,
则:![]() =44,解得x:y=1:2,即:丁烷和甲烷的物质的量之比为2:1,相同条件下的体积比也是2:1,C2H4O的物质的量为任意值,所以满足条件的为:①2:1:4、④6:3:2、⑤4:2:3,故合理选项是D。
=44,解得x:y=1:2,即:丁烷和甲烷的物质的量之比为2:1,相同条件下的体积比也是2:1,C2H4O的物质的量为任意值,所以满足条件的为:①2:1:4、④6:3:2、⑤4:2:3,故合理选项是D。


科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是植物秸秆的主要成分,以A为原料在一定条件下可获得多种有机物,它们的相互转化关系如图所示。已知F是一种最简单的烯烃。请回答:
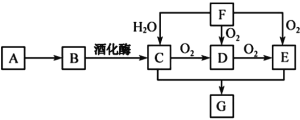
(1)F→C的反应类型是___。
(2)D的官能团名称为___。
(3)C+E→G的化学方程式是___。
(4)下列说法正确的是__。
A.D能被氧化成E,但不能被还原成C
B.实验室制备G时可用浓硫酸作催化剂和吸水剂
C.B、C、E三种物质可以用新制氢氧化铜悬浊液鉴别
D.相同质量的B、G完全燃烧生成水的质量相等
E.SO2气体与F均能使溴水褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是( )
A. 标况下,22.4L C2H2 中所含的 π 键数和 18g 冰中所含的氢键数均为 2NA
B. 双原子或多原子形成的气体单质中,一定有 σ 键,可能有 π 键
C. NH4+与 H3O + 均为 10 电子粒子,它们互为等电子体
D. 一个 P4S3 分子(结构如图)中含有三个非极性共价键
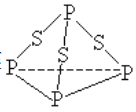
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于___________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式____________;两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能最大的为_______(用元素符号表示)。
(4)铜与Cl形成化合物的晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为________。它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为___________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类比推出的结论最终要经过实践的检验才能决定其正确与否。下列类推结论中正确的是( )
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.Cu与Cl2直接化合生成CuCl2;Cu与S直接化合也能得到CuS
D.CO2通入到硝酸钡溶液中不能生成沉淀;SO2通入到硝酸钡溶液中也不能生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题:

(1)A是制取氯气的发生装置,发生反应的离子方程式为_________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让![]() 充满整个装置,再点燃D处的酒精灯,
充满整个装置,再点燃D处的酒精灯,![]() 通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为
通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为![]() 和
和![]() 。D中发生反应的化学方程式为_______,装置C的作用是_________。
。D中发生反应的化学方程式为_______,装置C的作用是_________。
(3)E处溶液的颜色由紫色变为红色,再变为无色,请解释溶液由红色变为无色的原因_______,若将E处烧杯中的溶液改为硝酸银溶液,发生反应的离子方程式为________。
(4)D处反应完毕后关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有![]() 产生,此时B中出现的现象是_________。
产生,此时B中出现的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷铜制电路板的腐蚀液选取和回收再利用一直是研究的热点。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为_____。
②腐蚀结束后,通过以下两步可分离出铜,并实现FeCl3溶液再生。
![]()
步骤I所加试剂和操作分别为______。可实现步骤II转化的物质或方法是____(填一种即可)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如图:
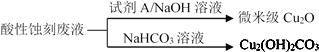
①蚀刻铜板主要反应的离子方程式为_____。
②回收微米级Cu2O过程中,加入的试剂A是____(填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是_____。
(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com