
【题目】SO2为无色、有强烈刺激性气味的气体,是主要大气污染物之一,具有一定的还原性。
I. 探究 SO2 还原 Fe3+、I2。可使用的药品和装置如下图所示。

(1)实验室常用亚硫酸钠与 70%硫酸 加热制备二氧化硫,写出该反应的化学方程式_________________________________。
(2)B中可观察到的现象是__________________。
(3)C的作用是______________。
(4)设计实验检验A 中SO2与Fe3+反应所得还原产物____________________。
Ⅱ.某同学将SO2与漂粉精进行如下实验探究。
操 作 | 现 象 |
取适量漂粉精固体,加入 100 mL 水 | 大部分固体溶解,溶液略有颜色 |
过滤,用 pH 试纸测漂粉精溶液的 pH | pH 试纸先变蓝(约为12),后褪色 |
将 SO2 持续通入漂粉精溶液中 | ①溶液出现浑浊,并呈淡黄绿色 |
②一段时间后,产生较多白色沉淀,黄绿色褪去 | |
(1)由 pH 试纸颜色变化说明漂粉精溶液具有的性质是______________________________。
(2)①中溶液呈淡黄绿色的可能原因是_________________________________;用离子方程式解释②中溶液黄绿色褪去的主要原因___________________________。
【答案】Na2SO3+H2SO4 ![]() Na2SO4 +SO2↑+H2O 蓝色溶液变浅直至褪色 吸收尾气SO2,防止污染空气 取少量实验后的 A 中溶液于试管中,加入铁氰化钾溶液,生成蓝色沉淀,说明反应所得还原产物为 Fe2+ 碱性、漂白性 Cl与 ClO 在酸性环境下反应生成氯气 Cl2+SO2+2H2O+Ca2+=4H++ 2Cl+ CaSO4↓
Na2SO4 +SO2↑+H2O 蓝色溶液变浅直至褪色 吸收尾气SO2,防止污染空气 取少量实验后的 A 中溶液于试管中,加入铁氰化钾溶液,生成蓝色沉淀,说明反应所得还原产物为 Fe2+ 碱性、漂白性 Cl与 ClO 在酸性环境下反应生成氯气 Cl2+SO2+2H2O+Ca2+=4H++ 2Cl+ CaSO4↓
【解析】
I.(1)亚硫酸钠固体和浓硫酸反应生成硫酸钠和水和二氧化硫,配平即可;
(2)B中二氧化硫被碘单质氧化生成硫酸和碘化氢;
(3)C中盛有NaOH溶液,其作用是吸收尾气 SO2,防止污染空气;
(4)装置A中SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,检验Fe2+可用铁氰化钾溶液;
Ⅱ.(1)pH试纸先变蓝(约为12),说明溶液呈碱性,之后颜色退去,说明具有漂白性。
(2)漂粉精中主要漂白成分为ClO-,它会与Cl-发生归中反应生成Cl2,氯气溶于水,溶液呈黄绿色。黄绿色褪去是因为溶液中的Cl2与SO2发生氧化还原反应,生成了SO42-和Cl-,又因为漂粉精溶液中还含有Ca2+,CaSO4微溶于水,据此写出离子方程式。
I.(1)亚硫酸钠固体和浓硫酸反应生成硫酸钠和水和二氧化硫,反应的化学方程式为Na2SO3+H2SO4 ![]() Na2SO4 +SO2↑+H2O。
Na2SO4 +SO2↑+H2O。
因此,本题正确答案是:Na2SO3+H2SO4 ![]() Na2SO4 +SO2↑+H2O;
Na2SO4 +SO2↑+H2O;
(2)B中二氧化硫被碘单质氧化生成硫酸和碘化氢,则B中反应的现象为:蓝色溶液变浅直至褪色。
因此,本题正确答案是:蓝色溶液变浅直至褪色;
(3)C中盛有NaOH溶液,其作用是吸收尾气 SO2,防止污染空气;
因此,本题正确答案是:吸收尾气 SO2,防止污染空气;
(4)装置A中SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,检验Fe2+的方法是取少量实验后的 A 中溶液于试管中,加入铁氰化钾溶液,生成蓝色沉淀,说明反应所得还原产物为 Fe2+。
因此,本题正确答案是:取少量实验后的 A 中溶液于试管中,加入铁氰化钾溶液,生成蓝色沉淀,说明反应所得还原产物为 Fe2+;
Ⅱ.(1)pH试纸先变蓝(约为12),说明溶液呈碱性,之后颜色退去,说明具有漂白性。
因此,本题正确答案是:碱性、漂白性;
(2)漂粉精中主要漂白成分为ClO-,它会与Cl-发生归中反应生成Cl2,ClO-+Cl-+2H+=H2O+Cl2↑,氯气溶于水溶液呈黄绿色。
黄绿色褪去是因为溶液中的Cl2与SO2发生氧化还原反应,生成了SO42-和Cl-,又因为漂粉精溶液中还含有Ca2+,CaSO4微溶于水,因此离子方程式为Cl2+SO2+2H2O+Ca2+=4H++ 2Cl+ CaSO4↓。
因此,本题正确答案是:Cl与 ClO 在酸性环境下反应生成氯气;Cl2+SO2+2H2O+Ca2+=4H++ 2Cl+ CaSO4↓。


科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
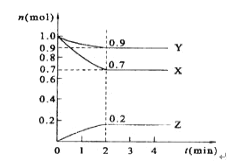
(1)X的转化率是_____;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_____;
(4)当反应进行到第____min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为_____;
(5)该反应达平衡时的平衡常数表达式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为:

已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如:

②酯比酰胺容易水解。
![]()
请填写下列空白:
(l)在稀酸条件下加热,化合物A首先生成的水解产物是:________和______。
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成:______________、________________和__________________。
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和__________________________。(填写结构简式,该分子中除苯环以外,还含有一个6原子组成的环)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业生产硼砂所得废渣硼镁泥(主要含 MgO、SiO2、Fe2O3,另含少量 FeO、CaO、 Al2O3 、B2O3 等)为原料制取 MgSO4·7H2O 的工艺流程如下:

回答下列问题:
(1)过滤需用到的玻璃仪器有玻璃棒、烧杯和_______;其中玻璃棒的作用是___________。
(2)滤渣 1 中的某种物质 是玻璃的主要成分之一,玻璃另外两种主要成分的化学式为_____________。除杂过程加入MgO 的作用是__________________。
(3)写出除杂过程中次氯酸钙将 Fe2+氧化的离子方程式__________________。
(4)除杂过程中,当 c(Al3+)=1×105 mol/L 时,c(Fe 3+)=__________mol/L。(已知Ksp [Al(OH)3] = 3.2×1034 , Ksp[Fe(OH)3]= 1.1×1036,结果保留两位有效数字 )
(5)滤渣 3 主要成分的化学式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是________,其中氧化性强的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出H2O2电子式___;上述反应的热化学方程式______。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是____kJ。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com