
一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( )
A.加入少量水,产生H2速率减小,H2体积不变
B.加入NH4HSO4固体,产生H2速率不变,H2体积不变
C.加入CH3COONa固体,产生H2速率减小,H2体积减小
D.滴加少量CuSO4溶液,产生H2速率变大,H2体积不变
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中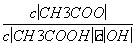 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.可利用废油脂制肥皂
B.袋装食品常用生石灰包作为食品的抗氧化剂
C.配制CuSO4溶液时加入少量的稀硫酸
D.用钠和钠的化合物做焰色反应实验,焰色均为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业上可利用“甲烷蒸气转化法”生产氢气,反应为甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,有关反应的能量变化如图1:
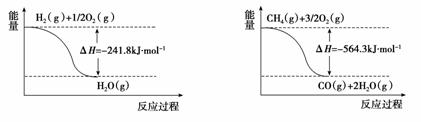
图1
则该反应的热化学方程式_____________________________________。
(2)已知温度、压强对甲烷平衡含量的影响如图2,请回答:
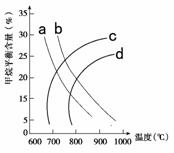
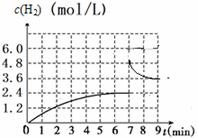
图2 图3
①图26-2中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________。
②该反应的平衡常数:600 ℃时________700 ℃(填“>”“<”或“=”)。
③已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,6min达到平衡(如图3),此时CH4的转化率为________________,该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。
④从图3分析,由第一次平衡到第二次平衡,平衡移动的方向是_____________(填“向正反应方向”或“向逆反应方向”),采取的措施可能是_____________________。
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中铵根离子浓度逐渐增大。写出该电池的正极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
 b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
c.晶体的熔点:金刚石<石墨
d.晶体中共价键的键角:金刚石>石墨
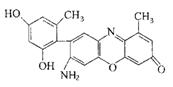
(2)某石蕊的分子结构如右图所示。
①石蕊分子所含元素中,第一电离能由小到大的顺序是 ,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式);
②该石蕊易溶解于水,分析可能的原因是 ;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2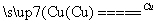 NF3+3NH4F
NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体,
②NF3与NH3均为三角锥形,但前者键角小于后者,原因是
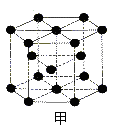 ③周期表中铜的相邻元素的晶体结构如图甲,则其一个晶胞中含有 个该元素,金属铜采取如图乙所示堆积方式,可称为____ 堆积。
③周期表中铜的相邻元素的晶体结构如图甲,则其一个晶胞中含有 个该元素,金属铜采取如图乙所示堆积方式,可称为____ 堆积。

乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com