
下列反应达到平衡后增大压强或降低温度,平衡都向正反应方向移动的是( )
|
| A. | 2NO2(g)⇌N2O4(g);△H<0 | B. | 3O2(g)⇌2O3(g);△H>0 |
|
| C. | H2(g)+I2(g)⇌2HI(g);△H<0 | D. | 2NH3(g)⇌3H2(g)+N2(g);△H>0 |
考点:
化学平衡的影响因素.
专题:
化学平衡专题.
分析:
根据勒夏特列原理进行判断.升温,加快化学反应速率,平衡向着吸热的方向移动,降温,减小反应速率,平衡向放热 反应方向进行;增大压强,加快化学反应速率,平衡向着气体体积减小的方向移动,增大压强或降低温度,平衡都向正反应方向移动,正反应方向是气体体积减小的放热反应.
解答:
解:平衡后增大压强或降低温度,平衡都向正反应方向移动,则正反应方向是气体体积减小的放热反应,
A、2NO2(g)⇌N2O4(g);△H<0,是气体体积减小的放热反应,故A正确;
B、3O2(g)⇌2O3(g);△H>0,是气体体积减小的吸热反应,故B错误;
C、H2(g)+I2(g)⇌2HI(g);△H<0,是气体体积不变的放热反应,故C错误;
D、2NH3(g)⇌3H2(g)+N2(g);△H>0,是气体体积增大的吸热反应,故D错误;
故选A.
点评:
本题考查影响化学平衡移动的因素,难度不大.要熟练掌握勒夏特列原理.


科目:高中化学 来源: 题型:
“柯达尔”是一种高聚物,其结构式为:

已知在一定条件下可以发生如下反应: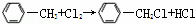
以石油产品(对二甲苯)为原料,合成“柯达尔”的方案如下:
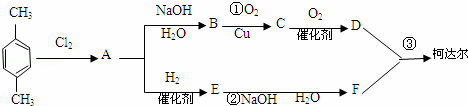
回答以下问题:
(1)指出反应的类型:A→B: ,A→E: .
(2)写出下列反应的化学方程式:B→C: ;E→F: ;D+F→柯达尔: .
查看答案和解析>>
科目:高中化学 来源: 题型:
食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A. 步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B. 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C. 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D. 步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物.
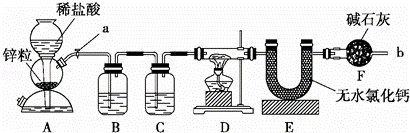
(1)如何检查装置A的气密性?
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,其目的是
(3)为了安全,在点燃D处的酒精灯之前,在b出口处必须 .
(4)装置B的作用是 ;装置C中装的液体是 .
(5)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是
(6)若FeO和Fe2O3固体混合物的质量为23.2g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为 g.
(7)U形管E右边又连接干燥管F的目的是 ,若无干燥管F,测得Fe2O3的质量将 (填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,在1L容器中,a mol SO2与b mol O2反应2SO2+O2⇌2SO3达到平衡时有c mol SO2发生了反应,则:
(1)生成 mol SO3;
(2)O2的转化率为
(3)平衡时容器内气体总物质的量为 ()mol
(4)平衡体系中SO3的百分含量(体积比) ×100%
(5)平衡浓度[SO2]= mol•L﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中 ,与100 ml
,与100 ml  0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A、1 00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
C、50  ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
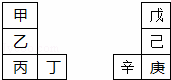
A. 金属性:甲>乙>丁
B. 原子半径:辛>戊>甲
C. 丙与庚的元素原子核外电子数相差13
D. 形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com