
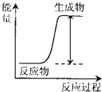
| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O | |
| D. | H2SO4+2KOH═K2SO4+2H2O |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
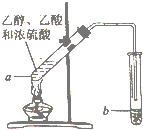 用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题:
用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).
CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2+SO2═H2SO4 | B. | I2+2Fe2+═2I+2Fe3+ | ||
| C. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | D. | SO2+2H2O+I2═H2SO4+2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
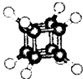
| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
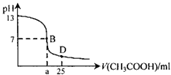 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )| A. | NaOH溶液起始浓度为0.1mol•L-1 | |
| B. | a>12.5 | |
| C. | B点溶液中c(Na+)一定等于c(CH3COO-) | |
| D. | D点溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
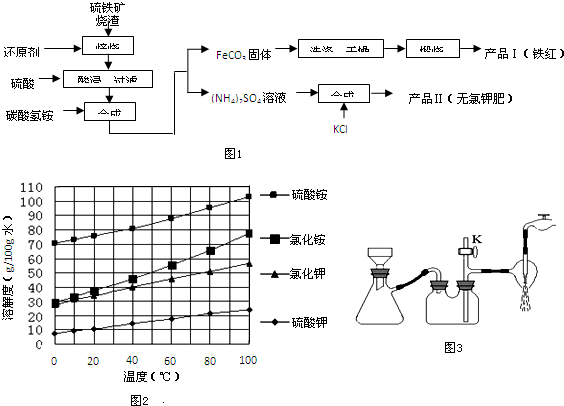
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com