
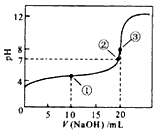
 (1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.
(1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.分析 (1)①点①加入10mLNaOH,醋酸过量,溶液呈酸性;
②若二者恰好中和,NaOH与醋酸的物质的量相等;
③若用氢氧化钠溶液来滴定未知浓度的醋酸溶液,滴定终点呈碱性;
(2)①高锰酸钾溶液具有强氧化性,不能使用碱式滴定管,可以选用酸式滴定管量取高锰酸钾溶液;
②选做基准试剂的物质必须满足纯度高、稳定性好,如硫酸亚铁、亚硫酸钠容易被氧化变质的试剂不能作为基准试剂;
③先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
④长时间放置后,高锰酸钾溶液浓度变小,滴定过程中消耗的标准液-高锰酸钾溶液的体积偏大,测定出的亚铁离子的含量偏高.
解答 解:(1)①点①加入10mLNaOH,醋酸过量,溶液呈酸性,离子浓度大小为c(CH3COO-)>c(Na+)>c(H+),
故答案为:c(CH3COO-)>c(Na+)>c(H+);
②若二者恰好中和,NaOH与醋酸的物质的量相等,因浓度相等,则体积相等,应等于20mL,故答案为:等于;
③若用氢氧化钠溶液来滴定未知浓度的醋酸溶液,滴定终点呈碱性,应滴加酚酞,达到终点时当滴入最后一滴氢氧化钠溶液时,溶液颜色从无色变成浅红色,且半分钟内不褪色 (或不恢复原来的颜色),
故答案为:酚酞;当滴入最后一滴氢氧化钠溶液时,溶液颜色从无色变成浅红色,且半分钟内不褪色 (或不恢复原来的颜色);
(2)①高锰酸钾溶液具有强氧化性,量取时应该选用酸式滴定管,
故答案为:酸式滴定管;
②硫酸亚铁、亚硫酸钠易被氧化,不稳定,浓盐酸易挥发,都易引起较大误差,只有草酸符合,故答案为:A
③草酸的物质的量浓度为:$\frac{\frac{Wg}{126g/mol}}{0.5L}$=$\frac{W}{63}$mol/L,
根据反应方程式6H++2MnO4-+5H2C2O4•2H2O═2Mn2++10CO2↑+18H2O,
2mol 5mol
c×VmL $\frac{W}{63}$mol/L×25mL
酸性高锰酸钾的物质的量浓度c=$\frac{2mol×\frac{W}{63}mol/L×25mL}{5mol×VmL}$=$\frac{10W}{63V}$mol/L;
故答案为:$\frac{10W}{63V}$mol/L;
④在放置过程中,由于空气中还原性物质的作用,使KMnO4溶液的浓度变小了,再去滴定水样中的Fe2+时,需要消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来的c(Fe2+)值会增大,测定的结果偏高,反应的离子方程式为:8H++MnO4-+5Fe2+═Mn2++5Fe3++4H2O,
故答案为:偏高.
点评 本题考查较为综合,涉及物质含量的测定以及酸碱中和的定性判断,侧重考查学生的分析能力、实验能力和计算能力,题目难度中等,明确滴定原理是解答本题的关键,注意基准试剂的选取方法,注意滴定终点现象不是褪色,而是变成紫红色.


科目:高中化学 来源: 题型:选择题
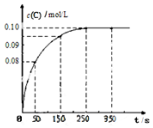 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 16g18O2中含有NA个氧原子 | |
| B. | 16gCH4中含有4NA个C-H 键 | |
| C. | 22g 某气体含分子数为 0.5NA,则其摩尔质量为 44 | |
| D. | 含 NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为 1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
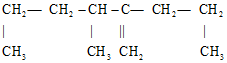 有机物,其正确命名应是( )
有机物,其正确命名应是( )| A. | 2,3-二丙基-1-丁烯 | B. | 2-丙基-3,5-二甲基-1-戊烯 | ||
| C. | 3-甲基-2-丙基-1-己烯 | D. | 3,5-二甲基-2-丙基-1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均相对分子质量 | B. | SO3(g)的转化率 | ||
| C. | $\frac{c(S{O}_{3})}{c(S{O}_{2})}$ | D. | c2(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和SO2 | B. | O2 | C. | H2S | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
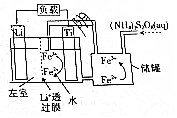
| A. | 左室电解质溶液为含Li+的水溶液 | |
| B. | 放电时,储罐中发生的离子反应为2Fe3++2SO42-═S2O82-+2Fe2+ | |
| C. | 充电时,钛极与外电源的负极相连 | |
| D. | 充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com