
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 常温下,1L 0.1mol·L-1醋酸钠溶液中加入醋酸至溶液为中性,则溶液含醋酸根离子数0.1NA
B. 6g SiO2晶体中含有Si-O键的数目为0.2NA
C. 1mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯分子数为NA
D. 某温度下, pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是
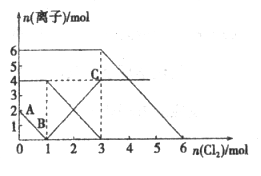
A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径与原子序数的关系如图所示.则下列说法正确的是( )
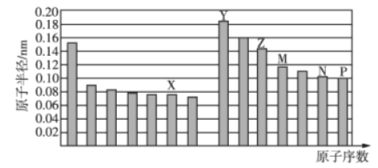
A.简单离子半径: Z>N
B.简单氢化物的稳定性: P > X
C.由 X 与 M 两种元素组成的化合物不能与任何酸 反应,但能与强碱反应
D.Z 的氧化物能溶解于 Y 的最高价氧化物对应水化 物的水溶液中,也能溶解于 P 的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质硼(B)及其化合物在化学工业中有诸多用途。工业上以硼镁矿(主要成分为Mg2B2O5·H2O,还含有少量的Fe2O3、FeO)为原料制备单质B的工艺流程如图所示:
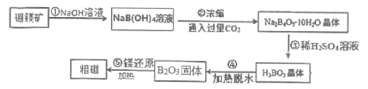
请回答下列问题:
(1)矿石中所含Fe元素在周期表中的位置_________;
(2)结合题目信息与元素周期律的有关知识,硼元素及其化合物的说法正确的是________;
A. 向碳酸氢钠溶液中滴加饱和硼酸溶液,有气泡产生
B. Al2O3为两性氧化物,可推知B2O3为两性氧化物
C. BF3分子中所有原子均达到8电子稳定结构
D. 已知硼能与NaOH溶液反应,方程式为:2B+2NaOH+6H2O=2NaB(OH)4+3H2↑
(3)上述流程中的①、②、③步骤中都用到了同一种分离方法叫___________;
(4)NaB(OH)4是硼酸的钠盐,组成该盐的四种元素原子半径由大到小的顺序为_________,硼氢化钠(NaBH4)是有机合成中的重要还原剂,其中B为+3价,NaBH4电子式_________,所含化学键类型________________;
(5)写出步骤⑤的化学方程式___________________;
(6)硼酸(H3BO3)是一元弱酸,工业上可以用电解NaB(OH)4溶液的方法来制备硼酸,同时得到氢氧化钠。其工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)。下列说法错误的是___________。
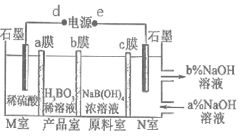
A . e与电源的负极相连接
B. 当电路中通过3mol电子时,可得到1mol H3BO3
C. 产品室中发生反应的离子方程式:H++B(OH)4-==H3BO3+H2O
D. a、c为阴离子交换膜,b为阳离子交换膜
E. M室的电极反应式为:4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的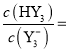 _____________。
_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com