
| A. | 标准状况下,11.2L苯中含有的碳碳双键数目为1.5NA | |
| B. | 常温常压下,2.8g由N2和CO组成的混合气体中含有的原子数为0.1NA | |
| C. | 25℃时,1.0LpH=12的Na2CO3溶液中含有的阴离子数大于0.01NA | |
| D. | 在反应:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,生成1molCu,转移的电子数为2NA |
分析 A、苯不是单双键交替的结构;
B、氮气和CO的摩尔质量均为28g/mol,且均为双原子分子;
C、pH=12的Na2CO3溶液中氢氧根的浓度为0.01mol/L;
D、反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2转移6mol电子,生成2mol铜.
解答 解:A、苯不是单双键交替的结构,故结构中无碳碳双键,故A错误;
B、氮气和CO的摩尔质量均为28g/mol,且均为双原子分子,故2.8g混合物的物质的量为0.1mol,含0.2mol原子即0.2NA个,故B错误;
C、pH=12的Na2CO3溶液中氢氧根的浓度为0.01mol/L,故溶液中氢氧根的个数为0.01NA个,但溶液中含有碳酸根和碳酸氢根等阴离子,故阴离子的个数大于0.01NA个,故C正确;
D、反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2转移6mol电子,生成2mol铜,故当生成1mol铜时,转移3mol电子即3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3.4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
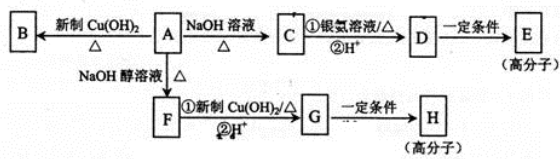
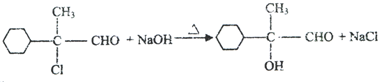 .
.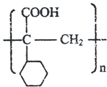 ,E的结构简式是
,E的结构简式是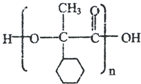 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 棕黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com